|
摘要:猪传染性胃肠炎病毒(TGEV)、猪流行性腹泻病毒(PEDV)和猪丁型冠状病毒(PDCoV)是猪的肠道病原性冠状病毒(CoVs)。在1946年鉴定TGEV,PEDV(1971)和PDCoV(2009)被认为是新兴的猪冠状病毒。1984年在比利时猪中发现了一株与仔猪呼吸道感染相关的猪传染性胃肠炎病毒(TGEV)突变体,命名为猪呼吸道冠状病毒(PRCV)。PRCV被认为是非致病性的,因为感染是非常轻微或亚临床的。自PRCV出现和迅速传播以来,大多数猪对PRCV和TGEV都具有免疫力,这大大降低了TGEV的临床和经济意义。相比之下,PDCoV和PEDV目前正在扩大其地理分布,有报道称TGEV-PEDV重组体的循环导致一种临床上无法与亲本病毒相关联的疾病。TGEV、PEDV和PDCoV可引起猪急性胃肠炎(新生仔猪最为严重),其临床症状和发病机制相匹配。感染的肠上皮细胞坏死导致绒毛萎缩和吸收不良性腹泻。大量腹泻和呕吐会导致脱水,从而导致仔猪死亡。自然感染后的强烈免疫反应可防止随后的同源攻击;然而,这些病毒却没有交叉保护。采用先进的生物安全措施和有效的疫苗控制和预防这些猪相关冠状病毒引起的疾病的发生。重组和毒力返强是与一般高效减毒疫苗相关的风险,需要进一步研究替代疫苗以确保其在该领域的安全应用。
关键词:猪冠状病毒·传染性胃肠炎病毒·猪流行性腹泻病毒·猪丁型冠状病毒·肠道病原体·猪呼吸道冠状病毒·病理学·检测·疫苗4.1序言
所有已知的猪冠状病毒(COV)都属于冠状病毒亚科的α、β和δ冠状病毒属(图1)。胃肠道、呼吸系统、外周神经和中枢神经系统的影响通常可见。共发现5种猪冠状病毒:(1)1946年首次定义的传染性胃肠炎病毒(TGEV);(2)1984年分离的猪呼吸道冠状病毒(PRCV),TGEV的突变体,1984年分离;(3)1977年分离的猪流行性腹泻病毒(PEDV);(4)1962年分离的猪血凝性脑脊髓炎病毒(PHEV);(5)2012年描述的PDCoV(猪deltacoronavirus)。前两种病毒,TGEV和PRCV,与猫和狗冠状病毒密切相关的属于α冠状病毒,PEDV和人冠状病毒(229E和NL63)在α冠状病毒属中形成不同分支。PHEV和PDCoV分别隶属于β冠状病毒属和δ冠状病毒属。PDCoV与亚洲豹猫和中国雪貂獾的δ冠状病毒有密切关系(Ma等,2005年)。PRCV主要诱发猪的亚临床感染,而肠道致病性猪α冠状病毒(TGEV、PEDV、SeCoV、猪肠道α冠状病毒)和PDCoV则与不同严重程度的肠道疾病有关,其严重程度取决于动物年龄和免疫状态。每种猪冠状病毒都只有一种血清型。
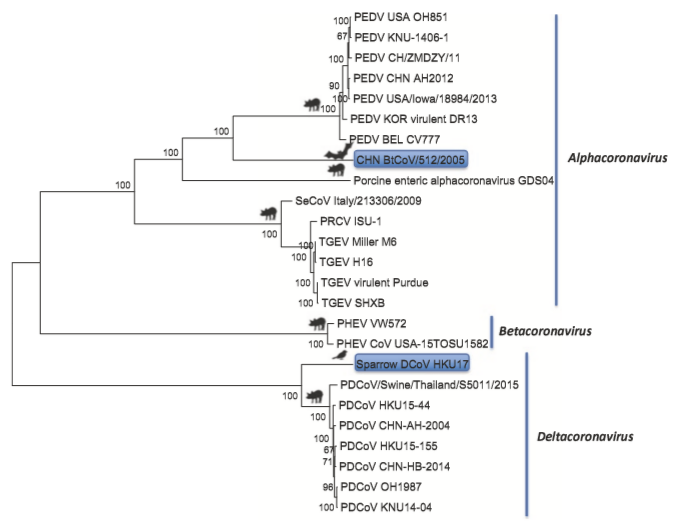
图1 猪冠状病毒α、β和δ冠状病毒属的系统发育树。闭合的圆圈表示潜在的非猪冠状病毒祖先。
据报道,TGEV和PEDV在欧亚大陆和美国共同传播,最近在欧洲发现并描述了一种致病性重组TGEV/PEDV变种(猪肠道冠状病毒,SeCoV)(Akimkin等人,2016年;Belsham等人,2016年;Boniotti等人,2016年)。在TGEV主干上含有PEDV S蛋白的SeCoV临床上导致的疾病和TGEV和PEDV导致的类似(表1)。此外,2017年在中国南部发现了一种与哺乳仔猪严重腹泻病相关的新型bat-HKU2样猪冠状病毒[猪肠道α冠状病毒(PEAV),GDS04株](Gong等人,2017年)(表1)。然而,其流行率和对猪宿主的适应状况尚不清楚。

目前,PHEV是唯一一种猪β冠状病毒,在世界范围内流行(Li等人,2016年)。在缺乏母源抗体的新生仔猪(通常是从无感染的猪群购买的)中,PHEV引起脑脊髓炎或以呕吐和消瘦为特征的疾病。一般来说,母源免疫VV保护吃初乳仔猪长达15周,而在3-4周龄的猪和成年猪中,感染主要主要呈现亚临床的。因此,很少有人认为它具有经济重要性。然而,最近一份关于美国成年展览猪出现不常见的呼吸道(流感样)症状和PHEV发病率增加的报告(Lorbach等人,2017年)可能表明潜在的倾向性转变,可能导致其流行病学发生重大变化。为了明确这一复杂的流行病学位置,需要持续监测和发展最先进的快速可靠的工具和技术,以确认和提供明确的鉴别诊断(Kim等人,2001年;Masuda等人,2016年)。
冠状病毒为有包膜的多形病毒,直径60-160纳米。猪冠状病毒游离的单链,聚腺苷,大基因组RNA(25-30kDa)的正链极性核酸是具有传染性的。基因组图谱、复制策略以及蛋白质表达与其他人和动物冠状病毒相匹配(Enjuanes和VanderZeijst,1995;Gonzalez等人,2003年;Laude等人,1993年)。大多数猪冠状病毒有四种基本的结构蛋白:一种大的表面糖蛋白(S,形成被定义为冠状病毒的纤突冠状蛋白);一种小的膜蛋白(E);一种完整的膜糖蛋白(M);和一种核衣壳蛋白(N)。然而,PHEV含有一种血凝素酯酶(HE)蛋白,形成第二层较短的表面穗状花序(deGroot等人,2008年)。TGEV、PEDV和PDCoV还转录由开放阅读框(ORF)3(TGEV和PEDV)、ORF6(PDCoV)和ORF7(TGEV和PDCoV)编码的1-2个辅助蛋白。其全基因组组织为5′UTR-ORF1ab、S、ORF3、E、M、ORF6、N和ORF7-3′UTR。
TGEV和PRCV的核苷酸和氨基酸序列的整体相似性为96-98%,表明PRCV是由TGEV进化而来的。PRCV基因组的两个特征可能解释了其组织取向的改变,包括暴发S基因N-末端缺失(621-681nt)导致S蛋白大小减少和ORF3的可变序列改变(Ballesteros等人,1997年;Sanchez等人,1999年)。
虽然没有证据表明存在不同的PEDV血清型(Lin等人,2015a),从遗传学上讲,PEDV株分为两类:(1)经典株(来自欧亚大陆的与原型CV777株基因相似的株)和(2)新兴的PEDV株(Lin等人,2016年;Vlasova等人,2014年)。所有经典的PEDV毒株都含有spike基因(SINDEL)中的插入和缺失,而这些插入和缺失在大多数高致病性的新兴PEDV毒株中并不存在(Vlasova等人,2014年)。因此,这些最初于2010年在中国出现并传播到美国、欧洲和其他亚洲地区的高毒力毒株被称为新兴的非SINDEL-PEDV毒株。这两大类PEDV之间的重组体在其S基因中含有一组与经典毒株相同的缺失插入。它们被称为SINDEL株,在亚洲、欧洲和美国流通。此外,一些报道描述了在S蛋白的N-末端结构域(NTD)中有大量缺失(194-216AA)并被指定为SNTDdel型PEDV的其他不常见的PEDV变体(Diep等人,2017年;Oka等人,2014年;Suzuki等人,2015年)。不同于从肠道TGEV到呼吸性PRCV的组织嗜性改变,这些(SINDEL和S1NTF已被报道为缺失毒株)PEDV毒株保持其肠道偏好,但具有较低的毒力(Suzuki等人,2016年;Hou等人,2017年)。
猪肠道冠状病毒(TGEV、PEDV和PDCoV)具有高度的传染性,与腹泻和呕吐等严重疾病有关,并增加了仔猪的死亡率(通常为100%)。它们可在养猪国引起零星暴发(地方性)或大规模流行病(图2)。到目前为止,在不同的地理区域,还没有针对任何猪肠道冠状病毒的特殊治疗方法。在本章中,我们回顾了家猪和野猪中继续进化的冠状病毒引起的疾病,以及另一个可能的宿主(鸟类或蝙蝠物种)或包括食肉动物在内的第二宿主,或通过种间传播、重组和产生缺失逃逸变体。我们还回顾了PRCV已失去其肠道倾向性,但能够诱导对TGEV的保护性免疫反应,从而改变其全球流行病学。
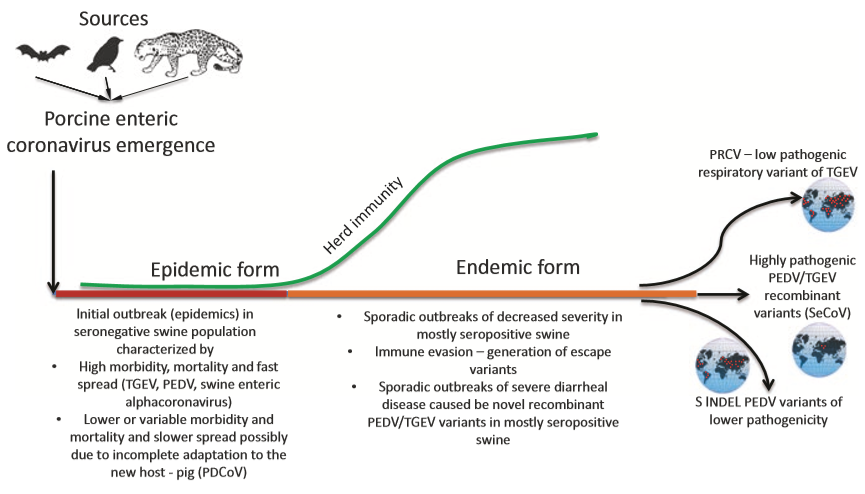
图2 猪肠道冠状病毒的不同进化阶段
4.2发病机制及临床表现
?TGEV
感染后24小时内,空肠和回肠成熟肠细胞广泛坏死,导致酶活性(碱性磷酸酶、乳糖酶等)降低,消化紊乱,细胞电解质(包括钠)平衡紊乱。这些变化主要导致肠腔积液,急性吸收不良性腹泻(Moon,1978)。仔猪血管外蛋白的丢失和大量脱水可能是致命的(Butler等人,1974年)。后者还可导致代谢性酸中毒和高钾血症,导致心功能异常。
TGE的大体病变仅限于胃肠道。胃和小肠的扩张被凝乳填满,有时还可见瘀点出血(Hooper和Haelterman,1966a)。小肠壁薄而透明。空肠绒毛萎缩和回肠绒毛萎缩是TGE的主要病变,新生猪比3周龄仔猪更为明显(Moon1978;Hooper和Haeltman,1966b)。TGEV感染的严重性增加导致小于2周龄的仔猪死亡率较高(通常为100%),而年龄较大的仔猪死亡率降低(表1)。尽管任何年龄的猪都易感染TGEV,但TGEV血清阳性组和5周龄以上猪的死亡率通常较低。表现出对临床疾病的年龄依赖性易感性的机制包括新生猪绒毛上皮细胞与从隐窝迁移的新分化肠细胞的缓慢替代(Moon,1978)。这些病变与PEDV/PDCoV病变相似(Debouck等人,1981年;Jung等人,2015a),但比轮状病毒(RV)引起的病变更严重(Bohl等人,1978年)。地方性畜群猪的病理观察和绒毛萎缩程度异常多变(Pritchard,1987)。
肺(肺泡巨噬细胞)和乳腺组织被认为是TGEV复制的肠外部位(Kemeny等人,1975年)。迄今为止的报告显示,由猪的口鼻感染TGEV引起的肺炎(Underdahl等人,1975年),乳腺感染的临床意义不明确。然而,猪传染性胃肠炎病毒感染母猪中常出现无乳症,猪传染性胃肠炎病毒在猪群中传播迅速。
PRCV
PRCV在猪1型和2型肺细胞中有效复制,见于鼻腔、气管、支气管和细支气管、肺泡的上皮细胞,有时也见于肺泡巨噬细胞(Atanasova等,2008年;Pensaert等人,1986年;O’Toole等人,1989年)。可见于血液和气管支气管淋巴结。实验感染后,鼻腔PRCV排毒通常持续4-6天。随着病毒中和(VN)抗体滴度的增加,肺部病变和临床症状随之消退(Atanasova等人,2008年)。尽管PRCV有时在肠上皮细胞中发现,但它不能有效地扩散到邻近的上皮细胞(Cox等,1990年),粪便排毒率低或无法检测到。
PRCV主要引起上下呼吸道疾病。病变似乎包括肺和支气管间质性肺炎,伴有规则的支气管周围和血管周围淋巴组织细胞性手铐(Atanasova等人,2008年;Cox等人,1990年;Halbur等人,1993年;Jung等人,2007年)。PRCV诱导的支气管间质性肺炎导致:(1)巨噬细胞和淋巴细胞浸润导致肺泡间隔增厚;(2)2型肺泡母细胞增生肥大;(3)气道上皮坏死导致肺泡和细支气管管腔细胞碎片和炎性白细胞聚集;(4)细支气管周围或血管周围淋巴组织细胞炎症。
?PEDV
感染后22-36小时临床症状明显,与病毒复制高峰相匹配(表1)。PEDV的临床表现(水样吸收不良性腹泻、呕吐、抑郁和厌食)和病理损害在临床上与TGEV无明显区别(Debouck等人,1981年;Coussement等人,1982年)。
仔猪发病率接近100%,母猪发病率不一。1周以下的新生仔猪常因严重脱水而死亡,死亡率高达50-100%,而年龄较大的猪死亡率较低,在一周内就会恢复。在母猪中,腹泻的严重程度是固定的,通常只表现为抑郁和厌食。同样,肥育猪可能会出现水样粪便,并在一周内变得厌食和抑郁。与TGEV一样,与断奶仔猪相比,受PEDV感染的仔猪肠道细胞周转缓慢和先天免疫系统发育不成熟可能会增加更极端的临床症状、更高的死亡率和更慢的恢复速度(Jung等人,2015a;Moon等人,1975年;Annamalai等人,2015年)。
每次暴发一般持续约3-4周;然而,在大型养殖场,在后备/母猪中有多个分离的单位和不同水平的母源免疫,暴发时间可能更长。妊娠母猪暴露于PEDV后,可提供足够的母源性免疫保护仔猪,PED的暴发也随之停止。急性暴发后,腹泻可能持续存在,并在断奶仔猪中反复出现,类似于地方性TGE形式(Martelli等人,2008年)。
在自然和实验感染的仔猪中,典型的PEDV、新出现的非S-INDEL和S-INDEL-PEDV株的损伤程度和病毒复制水平各不相同仔猪(Jung等人,2015年a;Coussement等人,1982年;KimandChae2003年;Pospischil等人,1981年;Sueyoshi等人,1995年;Lin等人,2015b;Madson等人,2014年)。病变仍然局限于小肠,小肠肿胀,充满了水状的淡黄色液体。镜下可见小肠肠上皮细胞主要在近端绒毛上合胞、空泡化和排毒。与TGEV相似,PEDV感染导致肠上皮细胞变性,降低绒毛高度与隐窝深度(VH:CD)比值和酶活性。尽管在结肠上皮细胞中检测到PEDV抗原,但未观察到相关的组织病理学变化(Debouck等人,1981年)。
病毒RNA已在PEDV感染期间被处死的猪的血清和不同组织(包括肺、脾、肝和肌肉)中得到证实(Suzuki等人,2016年;Jung等人,2014年、2015年a;Lohse等人,2017年;Chen等人,2016a;ParkandShin2014),血清中的RNA滴度高达7-8log10 GE/mL,与粪便中的RNA滴度峰值(11-12log10 GE/mL)一致(Jung等人,2015年a)。此外,在由新出现的PEDV毒株引起的流行期间,在40.8%(20/49)的母猪乳汁样本中鉴定出PEDV RNA(Sun等人,2012年)。
?PDCoV
仔猪和老年猪PDCoV感染后1-3天内观察临床症状。尽管临床症状相似(表1),但与PEDV和TGEV感染相比,它们不太明显(Chen等人,2015年;Hu等人,2016年;Jung等人,2015b;Ma等人,2015年)。它们包括由于吸收性肠细胞大量丧失而引起的吸收不良引起的急性水样腹泻。其他症状可能包括呕吐、脱水、体重减轻、嗜睡和死亡。感染结肠上皮细胞的空泡化可能抑制水和电解质的再吸收。血清阴性猪在任何年龄均易感染PDCoV,发病率高,仔猪可达100%。对2014年美国、中国和泰国的立案病例的评估表明,PDCoV感染与仔猪高达40-80%的死亡率相关(Anon,2014)。当怀孕母猪产生足以保护其后代的母源免疫时,对繁殖场所的感染仍然是自我限制的,并停止。
严重的病变包括肠壁变薄和透明(空肠到结肠),其中含有大量黄色液体和气体。胃部常因乳汁乳汁凝结而肿胀。
PDCoV在大肠和小肠上皮细胞中复制。病变与TGEV和PEDV感染相似,但较轻(Chen等人,2015年;Hu等人,2016年;Jung等人,2015b;Ma等人,2015年)。组织学表现为强烈、多灶至弥漫性、轻度至极度萎缩性空肠和回肠肠炎,在某些情况下伴有轻度的盲肠和结肠上皮细胞空泡化(Jung等人,2015年b)。在急性感染中,PDCoV抗原存在于空肠中部至回肠的绒毛上皮中,而在十二指肠和盲肠/结肠中则存在程度较轻的绒毛上皮(Jung等人,2016a年)。PDCoV抗原也可能存在于肠固有层、派尔氏结和肠系膜淋巴结的免疫细胞中(Hu等,2016年)。固有层可见炎性细胞(巨噬细胞、淋巴细胞和中性粒细胞)浸润。PDCoV感染的肠细胞急性坏死(Jung等人,2016a)导致空肠和回肠出现明显的绒毛萎缩,但十二指肠或大肠没有,这与十二指肠、盲肠或结肠上皮细胞的PDCoV抗原阳性较少一致(Chen等人,2015年;Jung等人,2015年b)。观察到血清中PDCoV-RNA滴度低的急性期病毒血症(Chen等人,2015年;Hu等人,2016年)。猪从临床疾病中恢复后,在肠道淋巴组织中发现大量PDCoV抗原(Hu等人,2016年)。此外,在多个器官中可检测到少量或中等数量的PDCoV RNA,但没检测到抗原,如病毒血症(Chen等人,2015年;Ma等人,2015年;Jung等人,2016年b)。粪便中PDCoV排毒水平的降低(与PEDV和TGEV相比)可能表明其对猪的不完全适应,并可能导致其在猪群中的传播速度减慢和哺乳仔猪的死亡率降低(Jung等人,2015年b)。
4.3发病率和流行率
?TGEV
TGEV于1946年在美国首次从仔猪高死亡率的急性腹泻暴发中发现(Doyle和Hutchings,1946)。从那时起,在几个实行集约化养猪制度的养猪国或地区,包括欧洲、亚洲(日本、韩国、马来西亚和中国台湾)、美洲(北、中、南)和非洲(加纳扎伊尔)都报告了这种疾病。尽管疫苗的广泛应用,TGEV感染是20世纪60-80年代美国和全球仔猪肠道疾病和死亡率的主要原因。TGEV缺失突变株PRCV的存在和广泛流行缩小了TGE的临床影响(Laude等人,1993年;Pensaert等人,1986年、1993年;BrownandCartwright1986年;Pensaert1989年;Yaeger等人,2002年)。目前,在北美、欧洲和亚洲,猪传染性胃肠炎病毒(TGEV/PRCV)血清阴性群中,仔猪因TGEV而出现大量腹泻的零星暴发尚待证实。然而,可能需要仔细区分TGEV和新兴的TGEV/PEDV重组子。
TGE有两种明显的流行病学形式:流行性和地方性。流行性TGE在血清阴性群体中表现突出。进入后,疾病迅速传播到任何年龄的猪,特别是在冬季,受影响的动物出现食欲不振、呕吐或腹泻。仔猪表现出显著的临床症状,并迅速脱水。泌乳母猪通常表现出厌食和无乳,产奶量减少,这进一步增加了仔猪死亡率。
地方性TGE表明病毒和疾病在一个群体中的持续存在,这个群体是由易感猪的不断涌入而延续的。它是原发性暴发的典型后遗症,常发生在有规律产仔的血清阳性动物身上(Stepanek等人,1979年),增加群体或混合易感猪群。在地方病群中,TGEV在成年猪中传播缓慢(Pritchard1987)。母猪大多具有时间抗性和无症状性,并将向其后代转移不同程度的被动母源性免疫。在这些组中,从约6天到断奶后2周。
?PRCV
PRCV通过粪便中的有限或无排毒感染呼吸道(Pensaert1989)。1984年首次从比利时分离出PRCV(Pensaert等人,1986年)。在美国,在没有TGEV感染或疫苗接种史的猪群中检测到PRCV(Hill等人,1990年;Wesley等人,1990年)。PRCV感染猪产生的抗体中和TGEV。
自第一份报告以来,该病毒在欧洲迅速传播(劳德等人,1993年;Brown和Cartwright,1986年;Have,1990年;vanNieuwstadt等人,1989年)并在世界范围内获得流行状态,包括进入无TGEV国家(Laude等人,1993年;Pensaert1989年;Pensaert等人,1993年)。1995年美国爱荷华州的一项血清学调查表明,来自不同畜群的临床健康猪的PRCV血清呈阳性(Wesley等人,1997年)。
?PEDV
从1971年到1980年代末,欧洲发生了几次致死性很强的猪流行病,而经典的PEDV株是其病因,但2000年以后的报道非常罕见。在意大利,2005年和2006年发生了一场涉及63个畜群的猪流行病,发现所有年龄段的猪都受到了影响,但死亡率主要限于哺乳仔猪(Martelli等人,2008年)。由于该病的临床重要性较低,直到2014年欧洲出现新的PEDV变异体,才进行监测研究。值得注意的是,欧洲猪群中经典PEDV的历史流行率是未知的。2014年,一种新出现的非SINDEL毒株导致乌克兰暴发疫情;而欧洲国家(德国、比利时、法国、荷兰和斯洛文尼亚)的疫情则被证实为SINDEL毒株(Lin等人,2016年)。
70年代末,中国最初报告了与经典PEDV株相关的感染。自那时起,PED在猪场中传播,并成为病毒性腹泻的主要原因,尽管使用了疫苗(针对原型PEDV株CV777)(Wang等人,2016a;Xuan等人,1984年)。在日本,PEDV是1982年首次发现(高桥等人,1983年),1990年代期间,仔猪疫情持续,死亡率在30%至100%之间(Sueyoshi等人,1995年;Kuwahara等人,1988年)。PEDV于1993年在韩国首次得到确认(Kweon等人,1993年),并且在90年代诊断的哺乳仔猪肠道病毒感染中占50%以上(Chae等人,2000年;Hwang等人,1994年)。在印度,528份来自猪(2-6个月大)的血清样本中,21.2%的人被证实为PEDV抗体阳性(Barman等人,2003年)。在泰国,2007年至2008年间,在八个省发生了PED(Puranaveja等人,2009年)影响所有年龄猪,但新生仔猪死亡率达到100%。
2010年10月,中国发生了一系列大规模的PEDV疫情,造成了巨大的经济损失(Sun等人,2012年、2016年)。这些暴发是由新出现的极强的非SINDEL毒株引起的,新生仔猪的死亡率达到50-100%(Wang等人,2016年b)。随后,中国也发现了新的SINDEL毒株(Wang等人,2016b),证明经典和新兴(非S-INDEL和S-INDEL-PEDV)毒株在中国共同流通。
2013年,新兴的PEDV毒株开始向中国以外的其他国家传播。在同一时期,美国猪场开始暴发由高致病性非SINDEL-PEDV株引起的疫情(Stevenson等人,2013年),随后在2014年1月暴发了与较温和的S-INDELPEDV毒株相关的疫情(Wang等人,2014年a)。然而,早在2013年6月采集的猪样本中就发现了SINDEL毒株(Vlasova等人,2014年)。2013-2014年,PEDV导致美国近10%的猪存栏量(700万头猪)和相关利润损失。据报道,到2018年,PEDV已经传播到39个美国州和波多黎各(www.aphis. usda.gov/animal-health/secd)。在美国,上一次大规模暴发的PEDV发生在2014年春季,据报道,新出现的非S-INDEL-PEDV株已蔓延到邻国,包括加拿大和墨西哥(Lin等人, 2016年)。
2013年,日本发现了新出现的非S-INDEL PEDV株(Masuda等人,2015)。然后据报道传播到了韩国(Kim等人,2015年)、越南(Vui等人,2014年)、泰国(CheunArom等人,2015年)、中国台湾(Lin等人,2014),以及菲律宾(Kim等人,2016年)。在日本检测到S-INDEL-PEDV株(Suzuki等人,2015),以及2013年和2014年在韩国(Lee等人,2014年)。到目前为止,在日本的猪身上检测到了其他携带S蛋白NTD大缺失的PEDV变异体。除了无毒的TTR-2毒株(Suzuki等人,2016年),从2013年12月至2015年6月收集的腹泻猪粪便或肠道样本中检测到15个新的野外PEDV突变体,S基因的NTD大缺失范围为582-648nt(Diep等人,2017年)。有趣的是,所有这些样本中至少含有两个具有明显大基因组缺失的PEDV株,并且大多数PEDV株被证实含有完整的S基因。在原发性和复发性PED暴发中均发现S基因大缺失的这些变异。总之,亚洲和欧洲存在经典的、新兴的非S-INDEL和S-INDEL-PEDV毒株,但目前只有新兴的非S-INDEL和S-INDEL-PEDV毒株被证实在美洲流通。到目前为止,在非洲和澳大利亚大陆尚未报告PED疫情。
?PDCoV
2007至2011年间,中国大陆和中国香港的初步调查表明,猪和野生鸟类的δ冠状病毒(Woo等,2012年)。尽管如此,在2005-2006年的中国活体动物市场上,包括中国雪貂獾和亚洲豹猫在内的小型哺乳动物中,δ冠状病毒的存在已经得到了证实(Dong等人,2007年)。由于dcov的螺旋酶和S基因与PDCoV密切相关,提示δ冠状病毒在亚洲食肉动物、猪和鸟类之间存在着种间传播。PDCoV的起源尚不清楚,但考虑到它最近的出现,它对猪的适应可能是不完全的。2014年初,在俄亥俄州的猪中首次发现了与PDCoV相关的腹泻。在俄亥俄州5个农场腹泻猪的肠道或粪便样本中,92.9%的样品通过RT-PCR检测为PDCoV阳性(Wang等人,2014年b)。PDCoV序列与2012年发现的两株中国PDCoV原型株HKU15-44和HKU15-155具有高度的核苷酸相似性。在同一时间段内,在美国发现了另外两个基因相似的PDCoV毒株,USA/IA/2014/8734和SDCV/USA/Illinois121/2014(Li等人,2014年;Marthaler等人,2014年a)。在美国19个州(www.aphis.usda.gov/animalhealth/secd)证实了PDCoV后,其传播范围仍不如PEDV。PDCoV在美国猪中的来源尚不清楚;然而,血清学证据表明,在2014年被确认之前,PDCoV已经在美国猪中传播(Sinha等人,2015年;Thachil等人,2015年)。
加拿大(2014年3月)、韩国(2014年4月)、中国大陆(2015年)、泰国(2015年)以及越南和老挝人民民主共和国也记录了PDCoV。韩国的一项研究报告称,2014年至2015年,从59个腹泻猪养殖场采集的691份粪便样本中,只有2份来自单一养殖场的样本为PDCoV-RNA阳性(Lee等人,2016a年)。两株韩国PDCoV株SL2和SL5与美国PDCoV株在遗传上有密切关系,但与韩国老毒株KNU14-04不同。继在香港的第一个PDCOV鉴定在2012(Woo等,2012年),在中国大陆腹泻猪中得到证实(Dong等人,2015年;Song等人,2015年)。PDCoV的患病率高(>30%),与PEDV的共感染率高(51%)。中国PDCoV株与全球PDCoV株具有较高的核苷酸同源性(>98.9%)。泰国PDCoV株与中国株CHN-AH-2004(Janetanakitetal等,2016),形成了一个与中国和美国不同的集群(Zhang,2016)。在老挝发现了与泰国PDCoV家族遗传关系密切的毒株,而在越南发现了与美国PDCoV毒株类似的毒株(SaengChuto等人,2017年)。
4.4免疫生物学
?TGEV/PRCV
成年猪感染可导致显著的血清抗体,可持续6个月至数年(Stepanek等人,1979年)。血清抗体的存在证实了TGEV或PRCV感染的血清学证据;它们与TGEV的保护作用尚未建立。从TGEV感染中恢复的猪显示出对随后的短期挑战的保护,如肠粘膜免疫(Brim等人,1995年;Saif等人,1994年;VanCott等人,1993年、1994年)。
保护性免疫依赖于肠浆细胞产生的分泌性IgA(sIgA)抗体(Saifetal,1994年;VanCott等人,1993年、1994年)。猪口服TGEV后检测到肠道和血清IgA-TGEV抗体和抗体分泌细胞(ASCs),但注射TGEV后未检测到(Saif等,1994年;VanCott等人,1993年、1994年;Kodama等人,1980年)。血清中存在IgA抗体(可能来自肠道)被认为是对TGE的主动免疫的一个指标(Kodamaetal,1980年;Saif,1999年)。除了局部抗体反应外,细胞介导免疫(CMI)在防止TGEV感染方面也很重要(Brim等,1995年;Frederick等人,1976年;Shimizu和Shimizu,1979年)。维甲酸可通过增加CD8+T细胞向淋巴结和小肠的转运,增强TGEV灭活疫苗免疫仔猪后的CMI(Chen等人,2016年b)。认为自然杀伤细胞(NK)活性低可能与仔猪和母猪对TGEV感染的高易感性有关(Cepica和Derbyshire1984)。一株毒性(SHXB)但未减毒(STC3)的TGEV毒株阻碍了猪肠道树突状细胞或单核细胞衍生树突状细胞在体内外采集抗原、迁移和刺激T细胞膨胀的能力(Zhao等人,2014),提示TGEV的免疫抑制潜力。
接种PRCV的猪产生了有效的全身和支气管相关但非肠道相关的抗体、ASC和T细胞反应(VanCott等人, 1993年;Brim等人,1994年)。除了TGEV或PRCV暴露引起的母猪乳汁中IgA抗体计数的数量差异外,建议使用乳汁IgA抗体观察到的病毒上皮细胞中的假定差异(DeDiego等人,1992年)。随着PRCV在欧洲的广泛分布,TGE在欧洲的流行性暴发大幅度减少,研究表明PRCV感染可诱导对TGEV的部分免疫,这一点已被大多数受检猪的病毒排毒和腹泻的时间和长度的缩短所证明(Brim等人,1995年;VanCott等人,1994年;Cox等人,1993年;Wesley和Woods,1996年)。这种部分免疫与TGEV-VN抗体的快速增加有关(Cox等人,1993年;Wesley和Woods,1996年)和肠内IgG和IgA-ASC的数量(Saif等人,1994年;VanCott等人,1994年)。TGEV激发后,PRCV-IgG和IgA-ASCs从支气管相关淋巴组织(BALT)转移到PRCV暴露的猪肠道,可能阐明快速的记忆反应,并诱导部分保护(VanCott等人,1994年)。然而,新生猪在遇到PRCV后一周需要对亚群对后续的TGEV攻击产生部分免疫(Wesley和Woods ,1996)。
通过初乳获得的循环被动抗体(主要是IgG)可保护新生仔猪免受全身感染,但不受肠道感染(Hooper和Haelterman,1966a;Saif和Sestak,2006)。在哺乳的前7天,乳汁中IgA占优势,IgG减少。研究人员回顾了TGEV感染的被动免疫机制(Saif和Sestak,2006;Chattha等人,2015年;Saif和Jackwood,1990; Saif和Bohl,1979)。从TGE中恢复的猪用含有TGEV病毒中和抗体(Hooper和Haelterman,1966a)的初乳或乳汁(母源性免疫)将被动免疫传播给其哺仔猪,这些抗体使在肠腔中摄入的TGEV无效。当仔猪定期或实验性地以免疫母猪为食时,这是自然完成的。
乳汁中的IgA-TGEV抗体在肠道中是稳定的,并提供最好的保护,但如果在注射肠外或全身疫苗(Bohl和Saif1975)后或通过摄入初乳IgG抗体(Stone等人)后乳汁中恢复高滴度,IgG抗体同样具有保护作用。1977年)。在TGEV感染和肠道内抗原刺激后,IgA免疫细胞转移到乳腺,在那里将IgA抗体限制并产生到初乳和乳汁中,在被动保护仔猪方面发挥主要作用(Saif和Sestak,2006;Saif和Jackwood,1990;Saif和Bohl1979;Bohl和Saif1975)。这种“肠-乳腺”免疫轴首次提出与猪TGEV感染有关(Bohl等人,1972年;Saif等人,1972年),为共同黏膜免疫系统提供了第一个概念。
?PEDV
尽管所有年龄段的猪都易感染PED,但1周龄仔猪和仔猪的死亡率最高,它们的存活取决于母源抗体的转移,特别是VN和sIgA(通过初乳和来自免疫或预先暴露母猪的乳汁)。TGEV感染的母源安全性成分也适用于PEDV(之前在TGEV章节中描述)(Chattha等人,2015年;Langel等人,2016年)。仔猪在断奶时对PEDV感染敏感而失去母源性保护。PEDV感染的体液免疫反应与TGEV完全相同(见TGEV章节)(Saif和Sestak2006;Chattha等人,2015年)。VN抗体出现在血清中,但对临床疾病的保护作用不明显,因为保护主要依赖于肠粘膜中slgA抗体的存在(Chattha等人,2015年;Langel等人,2016年)。免疫可能不会持续很长时间,但一个快速的记忆反应后,再次接触可能会降低严重程度的复发疾病,甚至防止它。
至少有11种蛋白质(ORF1ab编码的非结构蛋白(nsp1、nsp3、nsp5、nsp7、nsp14-16)、结构蛋白(E、M、N)和辅助蛋白ORF3s)被认为是IFN拮抗剂,允许PEDV逃避宿主干扰素(IFN)反应(Ding等人,2014年;Wang等人,2015年;Zhang等人,2016a年)。先天性免疫反应减少(特别是NK细胞的频率和功能)(Annamalai等人,2015年)可能导致仔猪与老年猪(断奶猪、育肥猪、成年猪)之间PEDV感染的严重性增加,如观察到的TGEV感染(Derbyshire等人,1969年)。
?PDCoV
猪对PDCoV感染的免疫反应尚不清楚,但推测与TGEV和PEDV相似。经口接种原始或组织培养的PDCoV株(OH-FD22)的无菌猪,其血清IgG、IgA和VN抗体为14dpi,当猪从临床形态和粪便病毒排毒中恢复时,其峰值为24dpi(Hu等人,2016年)。与TGEV和PEDV类似,母猪的初乳和免疫母猪的乳汁抗体,特别是IgA和VN抗体的供应,应能中和保护仔猪肠道中的PDCoV(Bohl等人,1972年;Saif等人,1972年)。
4.5诊断
4.5.1TGEV/PRCV
由于TGEV引起的临床症状和萎缩性肠炎也见于其他肠道感染(RV、PEDV、PDCoV和球虫),因此必须通过以下试验对TGE进行实验室诊断:确定粪便中的病毒抗原或核酸、从样本中分离病毒或检测TGEV抗体。
类似的方法也被用于PRCV的诊断,但重点是呼吸道标本(鼻拭子或肺匀浆)。对临床症状、组织学病变和组织中病毒抗原分布的评估可能会产生一个初步的诊断。
免疫荧光法(IF)检测小肠肠上皮细胞TGEV抗原(Pensaert等,1970年)或免疫组化(IHC)(Shoup等人,1996)技术-可对感染早期采集的福尔马林固定或冷冻组织使用抗高度保守TGEV N蛋白的单克隆抗体(MAb)。
基于单抗或多克隆抗体的酶联免疫吸附试验(ELISA)用于识别细胞培养、肠道内容物和粪便中的TGEV抗原(Lanza等人,1995年;Sestak等人,1996、1999a;van Nieuwstadt等人,1988),或鼻拭子或肺匀浆中的PRCV抗原(Lanza等人,1995),然而,可用的ELISA检测的灵敏度通常低于RT-PCR检测的灵敏度。RT-PCR或实时qPCR现在更常用于TGEV的检测和TGEV、PRCV、PDCoV和PEDV的鉴别(Kim等,2000年、2001年;Masuda等人,2016年;Costanti等人,2004年;Ogawa等人,2009年)。PRCV/TGEV的检测通常是基于PRCV株S基因缺失区的PCR检测。多重RT-PCR和实时qPCR已被用于同时鉴定与腹泻有关的主要猪病毒,包括RV、TGEV、PDCoV和PEDV(Masuda等人,2016年;Ogawa等人,2009年)。此外,多重微阵列杂交分析被用于快速鉴别包括TGEV在内的8种冠状病毒(Chen等人,2005年)。
用透射电镜(TEM)观察感染猪粪便或肠道中TGEV的含量。此外,免疫电镜(IEM)比透射电镜(TEM)具有许多优点,在区分TGEV与PEDV和PDCoV方面更为敏感和更好(Saif等, 1977年)。
初级和次级猪肾细胞(Bohl和Kumagai1965)或细胞系(Laude等人,1981年),猪甲状腺细胞(Witte,1971年)和McClurkin猪睾丸(ST)细胞系(McClurkin和Norman1966年)主张从感染猪粪便或肠道内容物中分离TGEV。典型的细胞病变效应(CPE)在原代分离野毒株时可以忽略,需要额外的盲传代。观察到的CPE包括肿胀的圆形细胞,外观呈气球状(Bohl和Kumagai1965)。为了观察病毒性CPE或斑块,在ST细胞培养基中加入胰酶或胰蛋白酶以及使用较老的细胞可以提高对病毒性CPE和斑块的检测(Bohl,1979)。
从鼻拭子或肺组织匀浆中分离PRCV的最佳方法是ST细胞和猪肾细胞。PRCV-和TGEV诱导的CPE与通常在Vero细胞中生长的PEDV中观察到的合胞体相当(Hofmann和Wyler,1988;Ksiazek等人, 2003年)。用特异性TGEV抗血清或特异性单克隆抗体(Garwes等人,1988年)和病毒特异性RT-PCR(Enjuanes和VanderZeijst,1995年;Laude等人,1993年;Kim等人,2000年)。
TGEV抗体可以通过几种血清学试验来鉴定。然而,TGEV血清学是复杂的,因为TGEV和PRCV都提示VN抗体是完全滴定和定性相似的(Pensaert,1989)。使用单克隆抗体进行TGEV的阻断酶联免疫吸附试验很容易与PRCV区分开来(Garwes等人,1988年;Bernard等人,1989年;Callebaut等人,1989年)。然而,阻断ELISA在群体基础上更有效,因为对TGEV或PRCV抗体滴度低的某些猪可能不会显示阳性(Callebaut等人,1989;Sestak等人,1999b;Simkins等人,1993年)。此外,用于区分PRCV和TGEV的美国毒株的商业ELISA的准确性较低(Sestak等人,1999a年)。
4.5.2PEDV
对于TGEV,诊断PEDV必须根据临床症状和实验室对病毒RNA、病毒抗原或PEDV种抗体的鉴定。对于PEDV RNA的确诊,最广泛使用的实验室技术是常规PCR(Kim等人,2001年;Ishikawa等人,或实时RT-PCR(Kim等人,2007)。对不同临床标本中病毒RNA的检测具有灵敏、特异、快速的特点。尽管环介导等温扩增(LAMP)分析(Ren和Li,2011;Yu等人,(015年)在检测PEDV RNA方面被认为是高度敏感的,但至今仍未到达诊断实验室。原位杂交可用于识别固定组织中的PEDV RNA(Stadler等,2015年)。
PEDV及其抗原的直接显示是在腹泻开始时和肠细胞排毒前,利用IF或IHC试验对安乐死的仔猪小肠组织进行的病毒颗粒可在腹泻猪粪便的直接EM或IEM中显示。然而,IEM必须用于区分PEDV和其他冠状病毒,即。TGEV和PDCoV,因为所有冠状病毒都具有不可区分的形态。
与粪便相比,使用肠道内容物/匀浆可提高Vero细胞中PEDV的成功分离率(Oka等人,2014年;Chen等人,2014年)。基于多克隆抗体和单克隆抗体的ELISA试验可用于检测粪便中的PEDV抗原(Callebaut等人,1982年;Carvajal等人,1995年)。
配对血清样本是地方性PEDV血清学诊断的必要条件。最近,在口腔液中观察到抗PEDV的IgG和IgA抗体,这表明它们可能适合于监测牧群先前接触PEDV的情况(BjustromKraft等人,2016年)。基于全细胞培养适应病毒抗原(Carvajal等人,1995年;Hofmann和Wyler1990年;Kweon等人,1994年;Thomas等人,2015),从受感染的Vero细胞中提取的S/N病毒蛋白(Knuchel等人,1992年;Oh等人,或细菌或哺乳动物表达系统(Wang等人,2015年;Gerber等人,2014年;Gerber和Opriessnig,2015年;Okda等人,2015年;Paudel等人,2014年)。阻断和竞争性ELISA还被用于利用单克隆抗体或多克隆抗体检测PEDV抗体(Carvajal等人,1995年;Okda等人,2015年;van Nieuwstadt和Zetstra,1991年)。抗PEDV N蛋白的血清IgG抗体可由9-14dpi检测到,其峰值约为21dpi,然后逐渐下降(Okda等人,2015年)。Vero细胞培养中的VN试验用于评估抗PEDV的VN抗体(Thomas等人,2015年;Okda等人,2015年;Paudel等人,2014年)。这些血清学检测通常用于筛选病毒前的确定性和评估疫苗的生存能力。
总的来说,建议使用实验室试验,以区分PEDV感染与TGEV、SeCoV和PDCoV。特别是对于由TGEV(主干)和PEDV(S蛋白)组成的SeCoV,最好采用基于检测TGEV(S基因以外的任何基因)和PEDV(S基因)的选择性检测方法。
4.5.3PDCoV
必须选择实验室检测来区分PDCoV感染与相关的PEDV、TGEV和RV感染。所讨论的TGEV和PEDV的方法学适用于PDCoV诊断。PDCoV感染的确认性发现包括检测粪便或肠道物质/组织中的PDCoV RNA或抗原。也可以利用针对PDCoV M或N基因保守区的RT-PCR分析进行诊断(Marthaler等人,2014年b;Wang等人,2014c),使用病毒特异性单克隆抗体或多克隆抗体的IF或IHC(Chen等人,2015年;Jung等人,2015b;Ma等人,以及原位杂交(Jung等人,2015年b)。建立了一种双联实时RT-PCR检测大肠和粪便中PDCoV和/或与PEDV鉴别的方法(Zhang等人,2016年b)。直接电镜可以显示腹泻猪粪便中的PDCoV病毒颗粒。然而,IEM的使用必须将PDCoV与PEDV或TGEV区分开来(Jung等人,2015a)使用高免疫或恢复期血清。然而,在LLC-PK或ST细胞中,除了少数毒株(OH-FD22)外,尝试分离PDCoV的成功率有限(Hu等人,2015年)。其他用于诊断PDCoV的血清学方法有IF、VN和ELISA。采用基于细胞培养病毒抗原的ELISA方法,对不同类型的血清和乳汁PDCoV抗体进行了定量分析(Ma等,2016)或S1和N病毒蛋白(Thachil等人,2015年;Okda等人,2016年;Su等人,2016年)。
4.6传播、风险因素和稳定性
4.6.1TGEV
TGEV在冷冻条件下更稳定,但在室温或更高温度下变得脆弱。在一项实验研究中,病毒的感染性在5℃下保持8周以上,在20℃下保持2周,在35℃下保持24小时(Haas等人,1995年)。此外,该病毒具有高度的光敏性,在阳光或紫外线照射下不到6小时就失去活性(Cartwright等人,1965年;海尔曼1962年)。它还能被1%溶血酶(苯酚和醛)、0.03%福尔马林、0.01%β-丙内酯、1mM二元乙胺、次氯酸钠、NaOH、碘、季铵化合物、醚和氯仿灭活(VanCott等人,1993年;Brown,1981年)。TGEV野毒株对胰蛋白酶具有抗性,在猪胆汁和pH值为3时相对稳定(Laude等人,1981年),让病毒在胃和小肠存活。
在温带气候中,TGE是一种季节性疾病,大多数暴发发生在冬季。据推测,这可能是由于病毒在冷冻状态下的稳定性,以及对热或阳光的脆弱性(Haelterman,1962年),使得病毒在冬季容易在猪群中以污染物或动物传播。三个可能的季节性流行之间的TGEV宿主是(1)有地方TGE流行的猪群;(2)除猪以外的宿主和(3)带毒猪。狗、猫和狐狸是可能的携带者,有助于病毒在农场上的传播,因为病毒的传播周期是可变的(Haelterman,1962;McClurkin等人,1970年),排泄的病毒(由狗传播)对猪仍然具有传染性(Haelterman1962;Reynolds等人,1980年)。
饲养场越冬椋鸟(Sturnus vulgaris)密度的增加有助于TGEV在寒冷季节在农场间的机械传播。在一项研究中,在喂食TGEV后的32小时内,在椋鸟的粪便中发现TGEV(Pilchard,1965)。同样,家蝇(Musca domestica)也被提议作为TGEV的机械载体(Pilchard,1965)。TGEV抗原出现在猪群的苍蝇中,TGEV从实验饲养的苍蝇身上排毒长达3天(Gough和Jorgenson,1983年)。值得注意的是,在中欧进行的调查证实,近30%的野猪体内存在TGEV抗体(Sedlak等人,2008年)。尽管TGEV排毒可检测到高达104dpi(Underdahl等人,1975年),尚未确定是否有传染性病毒粒子在那个时候排毒或传播。在过去一次TGE暴发后的3、4和5个月,向猪群中添加哨兵猪不会导致引进猪出现新的疾病(Derbyshire等人,1969年)。
4.6.2PRCV
猪群密度、农场距离和季节都对猪呼吸道冠状病毒病的流行病学造成影响(Pensaert,1989;Have,1990)。任何年龄猪只都可以通过接触或空气传播感染PRCV。在猪密度高的地区PRCV传播的风险增加,在该地区病毒可以传播几英里。
4.6.3PEDV
至于其他肠道病毒感染,在PEDV中也有直接或间接的粪便经口传播是病毒传播的主要途径。非免疫农场的急性疫情通常发生在新购猪抵达后的4-5天内。病毒主要通过受感染的猪进入农场,但也通过受污染的饲料、卡车、靴子或其他污染物进入。农场工人也可以充当病毒传播给未感染的猪的媒介(Dee等人,2014年、2016年;Schumacher等人,2016年)。一些研究报告了PEDV气溶胶传输的证据(Alonso等人,但不是其他研究(Niederwerder等人,2016年)。在感染新出现的非SINDEL-PEDV株的4周龄猪中,感染性病毒的排泄持续了14-16天(Crawford等人,2015年)。尽管如此,一些猪在最初经口暴露后的42天内排毒了PEDV RNA,但在粪便中发现了非传染性病毒颗粒。
与TGEV类似,在最初的养殖场暴发后,如果生产和断奶的猪数量足够,允许维持病毒,则PEDV可能成为地方病。值得注意的是,韩国的一份报告显示,野猪的PEDV感染率为9.75%(Lee等人,2016b),尽管它们在维持和传播PEDV方面的作用尚不清楚。
4.6.4PDCoV
PDCoV的主要传播途径是粪口传播。粪便、呕吐物和其他受污染的粪便是病毒的主要来源。实验诱发的PDCoV腹泻持续5-10天,粪便病毒RNA排毒持续19天(Hu等人,2016年;Ma等人,2015年)。猪在疾病恢复后,通常会继续在粪便中排毒PDCoV RNA;因此,PDCoV的另一个可能的宿主可能是亚临床感染或恢复期携带者。
4.7预防和控制
4.7.1TGEV
在野外条件下,对临床受影响的新生仔猪的治疗通常是无效的;但是,对1周或1周以上的仔猪补充电解质/葡萄糖溶液可以降低其死亡率(Bohl,1981)。额外的热量、深层被褥和抗生素溶液(用于治疗继发感染)通常可以改善仔猪的健康。
应加强生物安全措施,以减少从受TGEV影响的农场向易受感染的畜群引入受感染动物和受污染车辆的机会。TGEV感染不仅可以通过受感染的活动物传播,还可以通过屠宰的TGEV感染动物的未加工组织传播(Forman,1991)。
人们尝试了许多方法来免疫母猪以诱导母源性免疫和保护新生仔猪(Chattha等人,2015年;Saif和Jackwood,1990; Bohl和Saif,1975)。过去曾评估过几种不同给药途径(口服、鼻内、皮下、肌肉和乳腺内)的病毒疫苗(毒力、稀释、灭活和重组亚单位)(Saif和Sestak,2006;Moxley和Olson,1989)。值得注意的是,用减毒活疫苗、灭活疫苗或亚单位疫苗对怀孕母猪进行肌肉注射、肠外注射或乳内注射并不能提供完全的保护,但可以有效降低仔猪死亡率(Brim等人,1994年)。与自然肠道感染强毒病毒不同,弱毒病毒不能充分刺激肠道MG-sIgA轴,从而诱导类似于随后观察到的免疫。Merck Animal Health公司生产的用于联合口服肌肉注射的基于转基因TGEV活株的商业疫苗有两种:PROSYSTEM?TGE/Rota和PROSYSTEM?TREC。这些疫苗能有效地刺激先前接触的猪的反应,但不能保护未感染的猪群。
通过将所有母猪暴露于TGEV(利用受影响猪的肠道内容物或肠道组织)以提高产乳(乳汁)免疫,可以增强群体免疫(Bohl和Saif1975;Bohl等人,1972年)。这种做法被称为返饲,可使怀孕母猪(特别是在暴发后2周或更长时间内因产仔而产生的母猪)免疫迅速发展,并减少新生仔猪的损失。然而,它也可能导致其他病原体(可能存在于含有粪便/肠道内容物的TGEV中)传播到邻近的畜群。在小规模养殖场,实现了群体免疫,TGEV感染具有自限性。相比之下,在有连续产仔系统和易感动物不断涌入的大型农场(不超过200头母猪),TGEV感染在初次暴发后常常成为地方病(Saif和Sestak,2006年)。可以尝试用返饲方法消除猪群中的地方性TGE。在此之后,在接下来的3-4周内不应断奶仔猪,这样在TGEV在农场循环时,猪群中就没有易感宿主。
4.7.2PEDV
由于缺乏PEDV特异性抗病毒药物,治疗的重点是缓解腹泻病。感染PEDV的猪必须获得足够的水来减少脱水,这会加剧疾病的严重性。在疾病的急性期,暂时不喂食可能有利于肥育猪。
与TGEV一样,应采取适当的生物安全措施,避免将PED引入农场。目前的流行病学知识表明,病毒主要通过动物和人类传播,并通过受污染的饲料在农场之间传播(https://www.aphis.usda.gov/animal_health/animal_dis_spec/swine/downloads/secd_final_report.pdf)。建议仔细处理用具。
与亚洲的现状相反,在欧洲,PEDV感染(主要是循环中的轻度SINDEL毒株)被认为具有边际经济重要性,因此不需要开发疫苗(Lee,2015)。然而,亚洲严重的典型PEDV暴发,使得研制PEDV疫苗成为预防和控制该病毒感染的必要条件。在中国,基于CV777的灭活和减毒PEDV疫苗分别于1995年和1998年获得批准(Wang等人,2016年b)。不久之后,基于经典PEDV株KPEDV-9和DR13的减毒疫苗分别于1999年和2004年在韩国商业化(Kweon等人,1999年;Song等人,2007年)。自1997年以来,日本的母猪接种了一种基于细胞培养的商用减毒PEDV疫苗,该疫苗采用了经典的PEDVP-5V株(日本Nisseiken有限公司)(Sato等人,2011年)。这些基于经典PEDV株的疫苗在亚洲似乎能令人满意地控制PED,直到出现高毒性的非SINDEL PEDV株(Lee,2015)。如现场所示,经典的PEDV疫苗未能保护猪免受与新出现的高致病性非SINDEL PEDV株相关的严重腹泻病(Lee,2015)。
妊娠母猪故意暴露于PEDV(返饲法)可促进母源性免疫的快速发展,从而缩短疾病在农场的病程和严重程度(Chattha等人,2015年)。然而,如TGEV一节所述,这种方法可能有助于其他传染源在整个农场的传播。我们最近证明,与低剂量和模拟感染的母猪相比,给母猪注射高剂量的剧毒PEDV可显著提高其仔猪存活率(图3)(Langel等人,2016年)。这一新的发现表明,目前基于返饲的控制策略可以通过确保对怀孕母猪均匀施用高剂量PEDV来改进。
自2013年暴发以来,美国有条件地批准了两种针对新出现的非SINDELPEDV株的PEDV疫苗:基于α病毒的疫苗(Harris疫苗)?,现为默克动物健康公司)和灭活疫苗(Zoetis)(2014年)。第一种疫苗于2014年6月开发,使用了一种复制缺陷型委内瑞拉马脑炎(VEE)病毒包装系统,表达了一种新出现的非SINDEL-PEDV株的S蛋白(Crawford等人,2016年)。
图3 妊娠猪的PEDV剂量可能影响粘膜免疫反应和母源性免疫。在3-4周的准备期,母猪接受高、高、低PEDV剂量或模拟。所有仔猪在产后3-5天接受PEDV攻毒(Langel等人,2016年)2015年9月开发的第二种疫苗是灭活全病毒(非SINDEL-PEDV)疫苗加佐剂(Crawford等人,2016年)。2016年10月,基于非SINDEL PEDV株AJ1102的灭活疫苗在中国获得许可(Wang等人,2016年b)。在韩国,一种基于非S-INDEL株KNU-141112的灭活疫苗候选株被证明对母猪及其哺乳仔猪具有保护作用(Baek等人,2016年)。然而,这些疫苗/候选疫苗在实地的效力没有得到评估。迄今为止,已使用不同的方法为经典和新兴的非SINDEL-PEDV毒株生成了反向遗传学平台(Beall等人,2016年;Jengarn等人,2015年;Li等人,并可用于今后安全有效的PEDV疫苗的合理设计。
4.7.3PDCoV
对TGEV和PEDV的控制和预防所采取的疾病预防措施对PDCoV感染也有一定的参考价值。在没有任何合适的疫苗或抗病毒药物来控制PDCoV疾病的情况下,可靠的治疗方案包括给予碳酸氢盐液体和自由水以减轻仔猪的酸中毒和脱水症状。在并发/继发细菌感染的情况下,使用抗生素可能是有益的。在高死亡率的情况下,必须选择返饲技术来刺激母源性免疫和降低死亡率。此外,在PDCoV流行期间,必须实施严格的生物安全计划,以减少PDCoV通过受感染的媒介传播。全进全出系统和彻底消毒(使用酚类消毒剂、漂白剂、过氧化物、醛类或碘伏)可以打破疾病循环。
本文译自:
VLASOVA,A.N.,etal.PorcineCoronaviruses.In:EmergingandTransboundaryAnimalViruses.Springer,Singapore,2020.p.79-110.
|
