|
近期猪轮状病毒在我国养猪业卷土重来,造成重大的损失,为了帮助大家了解和防控好猪轮状病毒病,我们接下来将对轮状病毒病的防控进行介绍和讨论。
轮状病毒(rotavirus,RV)是引起人类和其他动物急性胃肠炎的主要原因之一,包括牛、绵羊、马、猪、鸡、火鸡、犬和蝙蝠。在全球范围内,人的RV造成了严重的人员死亡和经济损失。同时RV是引起仔猪和犊牛腹泻的主要原因之一。1969年,首次从牛中分离出RV(Mebus等人,1969年)。1975年,首次从腹泻仔猪中分离出RV(Rodger等人,1975年;Woode等人,1976年)。RV感染后导致动物生长缓慢、厌食、轻度至重度腹泻以及脱水,甚至造成死亡,可引起巨大的经济损失(Chepngeno等人,2020年)。
一、轮状病毒特性
“rota”一词来自拉丁语中的“wheel”。在电子显微镜下,RV呈轮状结构(Chang等,2012;Dhama等,2008)。图1 a为电子显微镜下RV颗粒。RV是一个无包膜的二十面体颗粒,由一个三层衣壳组成,其核酸包含11段双链RNA。这11个片段编码6种结构蛋白,包括病毒蛋白1(VP1)、病毒蛋白2(VP2)、病毒蛋白3(VP3)、病毒蛋白4(VP4)、病毒蛋白6(VP6)和病毒蛋白7(VP7)以及五种非结构蛋白(NSP),包括NSP1、NSP2、NSP3、NSP4和NSP5/6(Crawford等,2017;Molinari等,2016)。图1 b显示RV颗粒内所有主要结构蛋白的横截面示意图,图1 c显示11段RNA基因组和与每个RNA基因组片段相关的6种结构蛋白和5种非结构蛋白的电泳迁移模式。
图1 轮状病毒颗粒和结构(a、b、c)
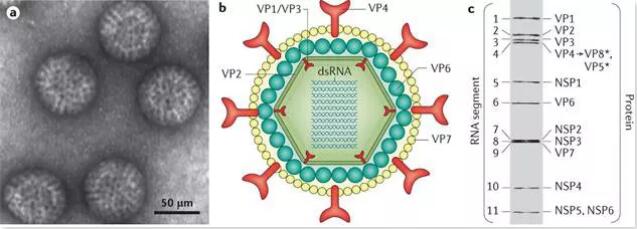
三层衣壳颗粒的外层由两种重要的病毒蛋白VP7和VP4组成。糖蛋白VP7形成了颗粒的光滑外壳层,而60个VP4二聚体、刺突蛋白从外壳层突出(Ludert等人,2002;Naseer等人,2017)。刺突蛋白的功能是促进病毒附着到小肠的成熟肠细胞上(Arias等,2015)。这两种蛋白诱导病毒中和抗体,他们是RV重要的分类、诊断和疫苗靶标。中间蛋白层由VP6组成(Desselberger,2014)。这种蛋白通过血清型或核苷酸序列将RV分离为不同的类群。内衣壳或核心衣壳由VP1、VP2和VP3组成。内衣壳由VP2组成,另外两个VP:VP1和VP3封装在衣壳内。VP1是一种病毒RNA依赖性RNA聚合酶,VP3是一种病毒加帽酶(Desselberger,2014)。
非结构蛋白在逃避宿主免疫系统、病毒复制和RV子代的形态发生中起重要作用。NSP1是最易变的,被认为与RV的宿主范围限制有关。NSP2和NSP5在形成病毒体中起重要作用,在病毒体中早期形态发生和RNA复制相关。NSP6与NSP5相互作用,存在于病毒体中。NSP4是最重要的非结构蛋白之一,原因有很多。它在内质网中充当新形成的双层颗粒的受体,通过增加感染细胞中的Ca++破坏细胞电解质稳态,改变质膜通透性,最重要的是,它充当病毒肠毒素(Desselberger,2014;Desselberger等,2009)。
二、轮状病毒分类
RV属于呼肠孤病毒科轮状病毒属(Arias等,2015;Chang等,2012;Resende等,2019)。目前根据其抗原性和核苷酸序列对其进行分类。中间衣壳VP6用于通过血清学技术、基因组RNA电泳模式和群体特异性PCR(Sanekata等,2003)从抗原上区分不同的RV类群。目前,已知RV有10个群组或类群(Chepngeno等人,2019年)。包括轮状病毒A(RVA)、轮状病毒B(RVB)、轮状病毒C(RVC)、轮状病毒D(RVD)、轮状病毒E(RVE)、轮状病毒F(RVF)、轮状病毒G(RVG)、轮状病毒H(RVH)、轮状病毒I(RVI)和轮状病毒J(RVJ)。已知能同时感染人类和动物的类群有RVA、RVB、RVC和RVH。已发现剩余RV类群RVD、RVE、RVF、RVG、RVI和RVJ仅感染动物(Chepngeno等人,2019年;Molinari等人,2016年)。
RV的两个外衣壳蛋白VP7和VP4是用于按血清型或基因型对RV进行分类的二元系统的基础(Greenberg和Estes,2009)。这两种蛋白都能诱导产生中和抗体,每种血清型的分类都是基于这些特征。在中和抗体试验中,VP7被分类为G血清型,VP4被分类为P血清型。G代表VP7的糖基化蛋白,P代表VP4的蛋白酶敏感蛋白。同样,在测序测试中,VP7被分类为G基因型,VP4被分类为P基因型。G血清型和G基因型的中和抗体试验和测序试验结果相似,故按G血清型(Gx)进行分类。这与P血清型和P基因型不同。中和试验和测序试验结果不一致。因此,P血清型被标记为Px,P基因型有括号P[x]。随着报道了更多的RV序列,显然需要更好的分类系统。
RVA是世界上已知的感染人类和动物的最普遍和有文献记载最多的类群。为了更好地描述和分类RVA的多样性,轮状病毒分类工作组(RCWG)于2008年4月成立。自成立以来,该小组已开发、评估并维持了一个基于核苷酸序列基因型的RV分类系统(Matthijnssens等人,2011年)。
在这个分类系统中,一个新的RVA毒株被分配了一个基于RVs 11片段基因组的基因型。不同的基因型基于一组“确定的核苷酸百分比阈值”(Matthijnssens等人,2008)。当前百分比每个片段的基因型值和数量见表1。新毒株的结构蛋白和非结构蛋白的顺序如下:VP7-VP4-VP6-VP1-VP2-VP3-NSP1-NSP2-NSP3-NSP4-NSP5/6。每一个结构蛋白和非结构蛋白的缩写顺序如下Gx-P[x]-Ix-Rx-Cx- Mx-Ax-Nx-Tx-Ex-Hx。RCWG建议了命名新RV毒株的命名法。该命名策略与“流感病毒资源”用于监测当前流感病毒株的当前命名策略相似(Matthijnssens等人,2011)。命名法如下:RV组/类群原产地/识别国家/通用名称/识别年份/G型和P型。使用这种命名法的RVA毒株的一个例子是RVA/Pig-tc/USA/Gottfried/1983/G4P。
表1 自2015年轮状病毒分类工作组在印度果阿举行的第7次会议以来,RVA基因型的多样性和同一性阈值百分比图片

上一次RCWG会议于2015年10月9日召开,从这次会议上,在RVA类群中发现的28种不同的G基因型(VP7)和39种不同的P基因型(VP4)获得了专家组的批准。不同基因型的所有更新见表1(Matthijnssens&Theuns,2015)。自上次RCWG会议以来,已收集到更多完整的RVB和RVC基因组。这些小组的研究人员正试图建立类似于RCWG的分类系统。
研究人员正在继续致力于为所有尚未建立系统的剩余RV类群创建与RVA相似的分类系统。
三、轮状病毒复制
了解轮状病毒的复制是很重要的,因为目前许多疫苗的开发策略都是基于病毒复制过程中重要的结构蛋白。我们目前对RV复制的大部分理解是通过在允许RVs复制的细胞系中进行的体外研究得出的。这些细胞系中的一个例子是通常使用的非分化MA104细胞(非洲绿猴肾细胞系)培养RVA类群(Arias等人,2015)。从这项工作中,RV毒株在细胞表面分子的偏好方面具有几个特征。根据宿主类群的不同,一些RV动物株使用刺突蛋白(VP4)与细胞聚糖(如唾液酸)结合,而其他动物RV病毒株和大多数人类RV病毒株被发现与组织血型抗原结合(Arias等,2015;Kim等,2017)。与唾液酸结合的RV毒株分为神经氨酸酶敏感型(与外部唾液酸结合)或神经氨酸酶抗性型(与内部唾液酸结合)。通过对人类和动物RV毒株的蛋白晶体学研究,目前仍在研究这些机制的确切工作方式。
一旦附着,在三层RV颗粒的外衣壳上发现的刺状蛋白经历蛋白水解裂解。在胰蛋白酶存在下,棘突蛋白(VP4)被切割成两个亚单位,VP5和VP8(Yoder等人,2009)。VP8亚单位促进RV与宿主细胞上发现的不同细胞表面受体的结合,VP5有助于病毒穿入(Li等人,2018)。这两个亚单位目前正被用于亚单位疫苗,将在第后面的章节进行更多讨论。目前的工作假设是RV通过直接穿透或受体介导的内吞作用穿透细胞。RV进入细胞的机制尚不清楚,正通过VP8结构的晶体学研究进行积极研究(Liu等人,2017)。
一旦进入宿主细胞,三层粒子脱落在寄主细胞的细胞质外衣壳层介导的低细胞内钙++和细胞酶。体外研究表明,糖蛋白VP7与钙结合,溶解三层RV颗粒的外层蛋白层(Ludert等人,2002)。剩余的双层粒子开始活跃地将11段RNA转录成细胞质中的加帽病毒mRNA。这些转录物被翻译成六种结构蛋白或五种非结构蛋白(Desselberger等人,2009)。
一旦产生足够的病毒蛋白,病毒复制就会发生在细胞质中的包涵体中,称为病毒体(即所谓的“病毒工厂”)。这些特殊的区域包括两个非结构蛋白,NSP2和NSP5。在这些病毒体中,来自11个片段的VP1、VP2、VP3、VP6和mRNA形成了一个双层粒子。NSP4位于粗面内质网(ER)外侧,作为受体,将新形成的双层颗粒排入ER。在ER内部,双层粒子被瞬间包裹,但当获得由VP7和VP4组成的外层时,双层粒子失去了包裹。目前,关于ER中发生的暂时包膜知之甚少。一旦颗粒成熟,三层颗粒通过细胞裂解从宿主细胞释放(Desselberger,2014;Desselberger等,2009)。
图片
四、公共卫生问题和人畜共患病的可能性
已知轮状病毒感染许多宿主类群,主要针对年轻动物。在人类中,5岁以下的儿童是受这种疾病影响最大的。2006年之前,美国(US)的RV感染导致超过300万病例,超过6万人住院,50万人就医,20-40人死亡(Desselberger,2014)。在2006年引进两种RV减毒活疫苗RotaTek?(默克)和RotaTrix?(葛兰素史克)后,RV病例,特别是发达国家的病例显著减少,因此死亡率也有所下降。然而,由于多个类群可以感染RV,因此人类和动物之间存在潜在的人畜共患传染病的公共卫生问题。
基于完整和不完整基因组分析的新RV分类系统有助于研究人员在分子水平上更好地理解RV进化。RV有11个片段的基因组,在体内和体外都能很容易地进行重组。Martella et al.(2010)描述了“驱动轮状病毒多样化的机制包括单点突变的正积累、片段间重组、重排和显著的重组。”这些进化事件导致猪和人类出现新的RVA G9和G12血清型(Shao等,2016)。在人类和猪身上出现新的RVA基因型的一个主要问题是,目前获得许可的疫苗不能抵抗这些新毒株。
最初,RV毒株被认为只在宿主类群内传播和感染。然而,有文献证明,感染猪和马、猪和牛以及猪和人的RV毒株之间发生了种间传播和重组(Chang等人,2012年)。Shao等人(2016)完成了体外和体内研究,研究了人类RVA(HRV)株Wa G1P[8]和猪RVA(PRV)株G9P[13]在无菌猪中的发病机制。研究人员对猪RV病毒株G9P[13]进行了全基因组测序,发现它“具有类似人类的G9 VP7基因型,但与历史上的PRV病毒株具有更高的核苷酸同源性。”本研究的其他发现包括:1)RV G9P[13]株比HRV G1P[8]株具有更长的病毒排毒时间和血清RVA检测时间;2)猪RV G9P[13]株在被HRV G1P[8]株的105个荧光形成单位或猪RV G9P[13]的105个荧光形成单位攻击的猪中产生短期完全交叉保护;人RV毒株G1P[8]对105个荧光形成单位猪RV G9P[13]的交叉保护作用有限。这是最早描述可能的异源G、P基因型间交叉感染保护作用的报告之一。为了保护人类安全,对猪轮状病毒基因型的持续监测对于出现人畜共患病的基因型具有重要潜力意义。
|
