|
陈璟州 ,丁一格,宋梓虢,孙珂欣,王小龙
(西北农林科技大学动物科技学院,陕西杨凌 712100)
摘 要:单碱基编辑技术是以CRISPR/Cas9(Clustered Regularly Interspaced Short Palindromic Repeats)系统为基础衍生出的能够对基因组进行精确定点编辑的一项新技术。与CRISPR/Cas9 技术系统不同,单碱基编辑系统通过在双链造成单切口后对碱基进行单碱基的替换,有效解决CRISPR/Cas9 基因编辑系统双链断裂易产生片段插入或者缺失的缺陷,提高单碱基编辑的精确性及效率。本文介绍了胞嘧啶碱基编辑器(Cytosine Base Editor)、腺嘌呤碱基编辑器(Adenine Base Editor)以及最新的引导编辑系统(Prime Editing)的建立过程、原理、优缺点及其在动物育种中的应用,并对单碱基编辑技术发展进行展望。
1 单碱基编辑技术的创建与优化
1.1 单碱基编辑技术的创建
单核苷酸变异(SingleNucleotide Variants,SNVs)是动植物产生性状变异的遗传基础,也是人类疾病发生的主要原因之一,其对动植物育种、基因治疗、药物开发等方面具有重要意义。因此,开发一种精确且高效实现碱基替换的技术显得尤为重要,在此背景下,研究人员开发了单碱基编辑系统。
1.1.1 CBE 的建立与原理
2016 年,Komor在Nature杂志上首次报道了基于CRISPR/Cas9系统,且不需要引入DNA双链断裂即可进行单碱基转换的基因编辑技术——CBE。与CRISPR/Cas9系统相比,CBE 在原系统基础上改造了Cas9 蛋白(dead Cas9、dCas9),并添加了胞嘧啶脱氨酶。Komor对野生型Cas9 蛋白上引入2个氨基酸突变Asp10Ala 和His840Ala,在去除Cas9蛋白剪切DNA双链的能力的同时,保留其结合DNA 靶位点的活性;而胞嘧啶脱氨酶有将胞嘧啶(C)脱去氨基变为尿嘧啶(U)的能力。该系统工作时,guide RNA 将dCas9 引导至靶位点,dCas9与DNA双链结合但不发生切割,胞嘧啶脱氨酶使靶位点上的胞嘧啶(C)脱去氨基变为尿嘧啶(U),当DNA 发生复制时,该靶位点上的尿嘧啶(U)会变成胸腺嘧啶(T),而DNA 双链中互补链中靶位点互补的碱基也会由鸟嘌呤(G)变为腺嘌呤(A),从而实现G:C 与A:T 碱基对的替换(图1)。

为进一步提高编辑效率,Komor还挑选了4种胞嘧啶脱氨酶进行测试, 分别是人类源AID酶和APOBEC3G酶、鼠源APOBEC1酶和来自七鳃鳗的CAD1酶,体外实验证明,鼠源APOBEC1酶的脱氨基活性最高,当其与dCas9蛋白的氨基端融合时,它们之间以一段XTEN 连接器连接(一段非结构重组多肽,目的在于提高融合蛋白的稳定性),XTEN连接器的长度影响脱氨基窗口的大小,越长则窗口越大,且其长度的合理增加也会使脱氨基效率得到提升。研究证明,当XTEN 连接器长度为16AA时,脱氨基精度与脱氨基效率之间能够取得最佳平衡,脱氨基窗口大小为5 nt,在前间隔序列邻近基序(PAM)位点前的4~8个核苷酸。APOBEC1-XTEN- dCas9 结构为第一代CBE系统,称为BE1。
2016 年,日本科学家基于AID(Activation- Induced Cytidine Deaminase,AID)同源PmCDA1和dCas9或Cas9n以及鸟嘌呤糖苷化酶抑制子UGI的融合,开发了有别于BE1 的一种碱基编辑系统;同年,Ma等也发现DNA碱基编辑的新方法,开发了基于哺乳动物的靶向AID介导的核苷酸突变(TAM),通过把诱导抗体高频突变的胞嘧啶脱氨酶AID与核酸酶缺陷的Cas9蛋白(dCas9)融合,在sgRNA的引导下靶向结合目标DNA 序列,使胞嘧啶和鸟嘌呤可以随机地向其他3个碱基转变。
1.1.2 ABE 的建立与原理
2017 年,Gaudelli等于Nature杂志上发表文章,阐述了ABE 的研发过程及原理(图2)。相较于CBE,ABE将胞嘧啶脱氨酶替换成了腺嘌呤脱氨酶。在ABE 碱基编辑系统的工作过程中,腺苷被水解去氨酸产生肌苷,肌苷在聚合酶活性位点的限制下能与胞嘧啶(C)配对,并被读取或者复制为鸟嘌呤(G)。腺嘌呤脱氨酶对DNA 链上的腺嘌呤产生脱氨基作用是创建ABE 系统的理论基石,但是在此前的研究中,腺嘌呤脱氨酶都只能作用于游离腺苷,无法作用于DNA链上的腺嘌呤,故而寻找能对于DNA链上腺嘌呤产生作用的腺嘌呤脱氨酶成为解决问题的关键。Gaudelli等对于一些可能具有相关腺苷脱氨能力的酶进行了改造与筛选,在此过程中,一种存在于大肠杆菌中名叫TadA的脱氨酶进入其视线。Gaudelli等研究发现,A106V 和D108N 突变的TadA酶具有DNA链上的腺嘌呤脱氨基能力,将改造的TadA酶(TadA*)与Cas9 D10A刻痕酶(取代了dCas9,便于定位信号的添加)结合,并在C端加上定位信号(NLS), 结构为TadA*-XTEN-nCas9-NLS,构成了第一代腺嘌呤碱基编辑系统(ABE),被称为ABE1.2。
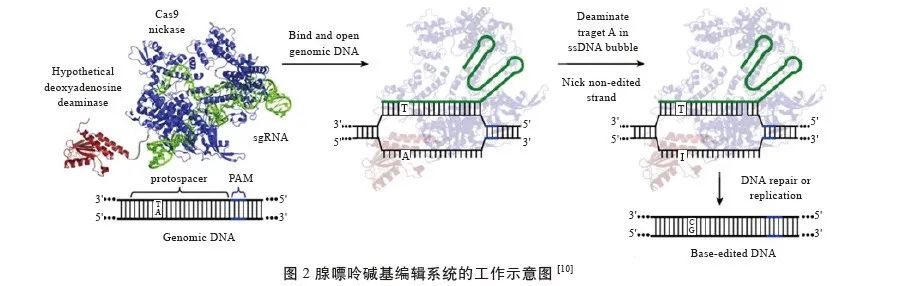
1.1.3 PE 的建立与原理
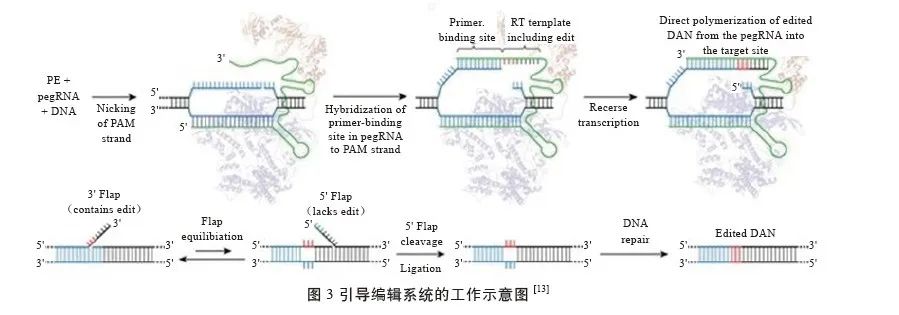
2019 年,Anzalone等在Nature杂志上介绍了PE 的建立过程和原理(图3),它能够实现目标序列碱基的插入删除和12种类型的碱基自由转换。PE系统的主要元件包括Cas9n(Cas9 H840A位点突变 ) 蛋白、逆转录酶(Reverse Transcriptase,RT)、编辑引导RNA(peg RNA, 既能指示目标位点,又包含取代目标DNA 核苷酸的新遗传信息)。其主要工作原理为在peg RNA的引导下,Cas9n 蛋白结合到目标位点并切断靶DNA,断裂的靶DNA链与pegRNA 上的PBS序列互补结合,RT酶使peg RNA 发生逆转录反应,待逆转录反应完成后,DNA切口处出现3'flap结构和5'flap结构的动态平衡(3'flap 结构上有目标突变,而5'flap结构上没有),但5'flap结构更易被结构特异性内切酶切除, 3'flap结构和5'flap结构的动态平衡会向5'flap结构这边倾斜,之后经过DNA 链的连接和修复便实现了目标序列的替换。Li等经过大量实验分析证明,PE系统编辑效率与同源修复相当且副产物少,脱靶效应也比传统的CRISPR/Cas9技术低。
由于PE于2019年被报道,只在少量类型的细胞中被测定过效率,活体验证结果寥寥无几。Liu等首先构建了单核苷酸突变的小鼠,用PE3系统诱导小鼠N2a 细胞中的X 连接雄激素受体(Ar)基因和同位素蛋白Hox-D13(Hoxd13)基因中的点突变,设计了独特的sgRNA,并在随后的实验结果观察中证明了体外筛选pegRNAs的必要性,揭示了现阶段PE系统体内效率低下的缺陷,作为介绍了使用PE在动物中生成有针对性的碱基突变的第1份报告,这份报告证明了人类细胞中的主要编辑系统在动物中的可行性,为其后PE系统的研究和发展以及使用提供理论基础。
1.2 单碱基编辑技术的优化
1.2.1 碱基编辑效率的优化
Komor等将尿嘧啶羰基化酶抑制蛋白(UGI)融合到BE1系统中,研发了第2代系统BE2,将编辑效率提高至20%。为进一步提高编辑效率,研究团队对dCas9进行了改造,恢复第840位氨基酸突变,保留Asp10Ala变异,使dCas9(A840H)蛋白具有DNA 单链的切口酶活性,这样可以只切割靶位点的非编辑链,使细胞启动错配修复机制(MMR)后只能以含U的单链为模板进行修复,大大提高了编辑效率,该系统被称为BE3,编辑效率达37%。此外,Koblan等通过增加个数不同的核定位信号(Nuclear Localization Signal,NLS)以及使用不同科研人员优化的密码子序列等方法构建了BE4max和AncBE4max这2种可在各种哺乳动物细胞进行高效编辑的碱基编辑器。
第1代腺嘌呤碱基编辑系统ABE1.2效率为3.2%±0.88%,无法满足在研究工作中进行基因编辑的需要,为此Gaudelli等构建了ABE1.2变种库,并提高抗生素筛选浓度,将ABE1.2发展至ABE2.1,提高至14%±2.4% 编辑效率;又将TadA序列与dead Cas9 融合构建成随机突变文库,通过结合卡那霉素、ABE 恢复霉素等抗性基因与相应的抗生素进行筛选,经过先后7轮改造后,将ABE 系统升级至ABE7.10,编辑效率达53.0%,编辑窗口为4~6个核苷酸。2021年,为对现有植物腺嘌呤碱基编辑器进行优化,中国农业科学院植物保护研究所作物有害生物功能基因组研究创新团队对TadA7.10衍生版本TadA8e、TadA8.17、TadA8.20进行评估,并在此基础之上开发出全新版本TadA9,将多个测试靶位点处的碱基编辑效率逐步提高至90%以上,并证实了TadA9 和TadA8e 能与众多Cas9衍生蛋白和同源蛋白广泛兼容,包括SpCas9n、SpCas9n-NG、SpRYn 和ScCas9n。
1.2.2 碱基编辑窗口的优化
不同类型的碱基编辑系统的编辑窗口不同,在实际研究应用中,也需要对编辑活性窗口做出相应的改动。当碱基编辑器被用于精准改变某个特定的碱基时,过大的脱氨化窗口会导致窗口内非靶标碱基的编辑。由于CBE只能对胞嘧啶脱氨酶活性位点附近的C脱氨基,而胞嘧啶脱氨酶rAPOBEC1的活性窗口通常有5个核苷酸,会使活性窗口中非靶向的碱基也发生替换作用从而发生脱靶,Kim等对胞嘧啶脱氨酶进行突变,在降低酶的活性的同时,通过改变底物的结合和构象直接降低底物进入胞嘧啶脱氨酶活性区域的能力,将单碱基编辑系统的活性窗口5个核苷酸缩小至1~2个核苷酸。
然而,当碱基编辑系统被用于筛选功能基因、进行可变剪接、编辑调控元件等时,较大的编辑活性窗口更有利于研究。Zhang等将10个非序列特异性的ssDNA结合结构域(ssDBD) 与CBE 进行融合,筛选发现将Rad51蛋白的ssDBD 融合到APOBEC1 与Cas9n之间能够显著提高碱基编辑活性,同时大幅扩大编辑窗口。此外,CP1012-ABEmax、CP1028-ABEmax、CP1041-ABEmax和CP1249-ABEmax碱基编辑器在保证效率与ABEmax相当的情况下,可将 4~8位的碱基编辑窗口拓展为4~12位。
1.2.3 碱基编辑范围的优化
常用的碱基编辑器大部分都与化脓性链球菌的Cas9(SpCas9)蛋白进行融合使用,只能靶向含有NGG或NGA序列的PAM位点,限制了其在基因组中的靶向范围。因此,研究人员将SpCas9替换为其他Cas蛋白, 通过不同Cas蛋白识别不同PAM,进而扩大碱基编辑系统在基因组中的编辑覆盖度。Kim等使用金黄色葡萄球菌的Cas9(SaCas9)、SaCas9突变体(Sacas9-KKH)、SpCas9突变体(SpCas9-VQR、SpCas9-EQR、SpCas9-VRER)替代SpCas9,识别含有NGG、NGA、NGAN、NGAG、NGGG、NNGRRT和NNNRRT的PAM 序列,显著扩大了单碱基基因编辑的靶向范围;此外,通过dCpf1和Sp-macCas9的融合,科研人员突破CBE之前只能识别富含GC序列的PAM位点的限制,使识别范围拓宽至富含AT序列的PAM位点。
1.2.4 碱基编辑脱靶问题的优化
碱基编辑在应用中的脱靶效应会造成无法预计的后果,为了更安全地利用碱基编辑技术,寻找一种科学快速的脱靶检测手段势在必行。2020年,中国科学家建立了一种名为GOTI(Genome-wide Off-target analysis by Two-cell embryoInjection)的新型脱靶检测技术,它提高了基因编辑技术脱靶检测的敏感性,可以在不借助于任何脱靶位点预测技术的情况下发现之前的脱靶检测手段无法发现的完全随机的脱靶位点,为碱基编辑的脱靶研究提供了新的方法。其次,gRNA特异性的改良对于脱靶问题的解决也具有重要意义,如在一定范围内适当调整gRNA长度也能降低脱靶效应;调整gRNA 上游5'的发夹结构可提高Cas9和Cas12的特异性,并将脱靶效应降低55倍。此外,Cas9蛋白的改造也是降低脱靶效应的手段。SpCas9-HF(经过设计的高保真SpCas9变种)在人体细胞基因编辑中表现出超常的准确性,同时,只表现出微量的脱靶效应;对于人类细胞基因组编辑,特异性增强的eSpCas9(K848A、K1003A、R1060A)可减少非目标链结合,从而增强基因编辑的特异性。
2 单碱基技术在动物育种中的应用
2017年, Kim等通过BE3编辑小鼠胚胎Tyr基因和Dmd基因,建立了小鼠白化病和肌营养不良疾病模型;Zhang等通过编辑斑马鱼胚胎的Tyr 基因建立了模拟人类眼白化病的疾病模型;松阳洲实验室利用HF2-BE2高效编辑小鼠Tyr基因,建立了小鼠白化病模型,突出了利用基础编辑器2进行基因编辑的优势。
2018 年,Ryu等将ABE7.10包裹到双反式剪接的AAV病毒系统中,递送到Dmd小鼠模型中进行无义突变的较正,成功治疗了杜氏肌营养不良的小鼠疾病表型;Liu等利用BE3碱基编辑系统对兔MSTN 基因进行编辑,使其在外显子的1 处发生胞嘧啶(C)到胸腺嘧啶(T)的突变,从而提前产生终止密码子使基因无法转录而失活,最终携带该位点突变的突变型兔相较于野生型兔显示出了双肌表型;Li 等结合BE3和体细胞核移植方法,通过在猪胚胎成纤维细胞中编辑Twist2基因和Tyr基因建立了无脸巨口综合征和皮肤白化病的疾病模型。
2019年,赖良学课题组将胚胎注射和体细胞核移植等动物创制方法与单碱基编辑技术相结合,分别在猪的细胞、胚胎和个体3个水平上对猪的多基因位点进行单碱基编辑,培育出了单基因突变的早衰猪模型和杜氏肌肉营养不良猪,同时也得到了与免疫机能相关的多基因突变的缺乏B细胞、T细胞和NK细胞的免疫缺陷猪;Zhou 等把BE3 的编码mRNA 和sgRNA注射到绵羊受精卵中, 对细胞因子信号抑制2基因(Suppressor Cytokine Signaling 2,Socs2)实现了目的性的精准突变,获得了在体型、体重和产奶量等性状上明显优于野性型羔羊且生长状况良好的基因编辑羊,后续研究发现Socs2 Indels也可以在炎症肠炎状况下有效保护骨骼健康;Li 等、Wang等结合BE3系统和显微注射技术对单细胞胚胎中的成纤维细胞生长因子5(FGF5)编码基因进行高效精确的碱基编辑,后续检验发现,FGF5 基因编辑山羊毛纤维显著长于野生型山羊,毛囊也显著多于野生型山羊。
2020年,Zhou等根据骨形态生成蛋白受体1B(BMPRIB)基因p.Q249R位点的序列信息设计了包含目标突变的sgRNA,将其与ABE(ABE7.10、ABEmax或 xCas9-ABE)质粒共转染入绵羊成纤维细胞中筛选了高效的ABE版本,之后结合胚胎显微注射技术成功创制了携带高效率编辑基因的后代羔羊,证明了利用ABE系统在大型动物中进行单碱基编辑的可行性,并为改善动物生产提供了替代方法,有助于验证农业重要特征的关键SNP。
总而言之,单碱基编辑技术在动物育种中相较于之前的前3代基因编辑技术极大地提升了编辑效率和编辑精度,在前3代技术覆盖的大部分领域都能发挥重大的作用,能够有效地推进遗传改良的进度,提升改良育种效果。
3 单碱基编辑技术发展与展望
碱基编辑技术是在CRISPR/Cas9系统的基础上发展建立起来的。相比于 CRISPR/Cas介导的HDR编辑,其最大优势就是可以在不产生 DSB的情况下实现高效精准的编辑,显著提高基因编辑的精准度,在作物遗传改良与家畜育种研究中,碱基编辑技术展现了很好的应用前景,但仍存在一些不足。一是效率问题,虽然相较于之前的基因编辑技术,单碱基编辑系统的打靶效率显著提高,但大部分位点效率在20%~40%(植物中),仅在个别位点上能够达到60%以上,PE编辑系统的效率更为低下;二是应用范围的限制,大多数单碱基编辑系统都是对于特定位置碱基进行编辑的,虽然现在许多研究人员都对Cas蛋白进行了改造,产生了多种可以选择的PAM位点,但还是无法满足基因编辑的实际应用需求;三是脱靶现象,相较于常规CRISPR/Cas9技术,单碱基编辑系统不需要产生DSB,显著降低了脱靶效率,但仍存在一定的脱靶现象。未来的单碱基编辑技术将以这3个问题为主要发展的方向,即开发出应用范围更广、编辑位点更精确、更低脱靶概率的单碱基编辑系统。综上所述,单碱基编辑技术虽然已经在人类遗传疾病研究及相关动物模型制备、药物开发、动植物育种等方面显现出巨大潜力,但并未完全满足实际的基因编辑需求,在编辑精度和编辑效率上面还存有很大进步空间,在应用中也存在着一些限制,尤其是编辑窗口的限制。
因此,如何使碱基编辑系统摆脱编辑窗口的限制,实现sgRNA覆盖范围内所有位点的高效率精准编辑,将是未来研究中的重大课题。随着单碱基编辑技术的不断完善成熟,相信单碱基编辑技术会成为强有力的生物研究工具,极大地推动全世界生物科学相关领域的快速发展。
本文刊登在《中国畜牧杂志》2022年6期,如需转载,请注明来源。
|
