|
摘要:A型塞内卡病毒(Senecavirus A,SVA)是新发现的一种影响养猪业的RNA病毒,现已在美洲的美国、加拿大、巴西、哥伦比亚以及亚洲的中国、泰国、越南等多个国家被发现。2015年SVA首次在我国广东省发现后,已有15个省、自治区和直辖市报道检测到该病毒,表明SVA已在我国不同地域广泛分布。猪感染SVA后的临床症状与口蹄疫、猪水泡病及水泡性口炎等类似,难以鉴别。SVA的实验室诊断多采用病原学和血清学方法。对于该病目前仍无商品化疫苗可用,但已有研究出重组活疫苗候选株和油佐剂灭活候选疫苗的报道。SVA未来的流行态势目前难以预测,因此需密切关注SVA在全球的流行现状,并深入研究SVA的致病及免疫机理,同时尽快研发有效的疫苗和诊断试剂。通过病原学、临床症状、流行状况、诊断方法、疫苗研发等方面的综述,本文为我国SVA防控提供了参考。
A型塞内卡病毒(Senecavirus A,SVA),旧称塞内卡谷病毒(Seneca Valley virus,SVV),属于小RNA病毒科(Picornaviridae)塞内卡病毒属(Senecavirus)成员。该病毒于2002年在美国马里兰州的“塞尼卡河州立公园(Seneca Creek State Park)”附近的实验室首次被发现,具有偶然性,最初是从被胎牛血清或猪胰蛋白酶污染的PER.C6细胞系中分离到,而来自猪胰蛋白酶污染来源的可能性更大,因为大量与SVA血清学相关的病毒都分离自猪。
SVA自2007年逐渐在加拿大、美国、巴西等国家暴发。2015年我国广东省首次发现该病毒,随后逐渐蔓延至其他省份。猪感染SVA后的临床表现与感染口蹄疫病毒(foot-and-mouth disease virus,FMDV)类似,通常表现为沉郁、体温升高、厌食、跛行、蹄部和鼻吻出现水疱。水疱是该病的典型症状,蹄部水疱常见于蹄冠带和趾间隙。SVA感染的诊断目前主要依赖于病原学和血清学方法,防控方面仍无商品化疫苗可用。另外,随着SVA在我国的传播,其毒力也逐渐致弱,目前国内猪场已频繁出现亚临床感染情况。大量的亚临床感染及无商品疫苗可用,增加了我国对该病的防控及净化难度。
分子生物学
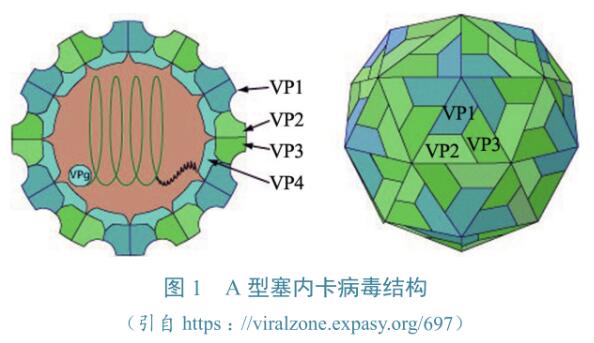
SVA粒子结构
SVA结构(图1)与FMDV类似,为非囊膜正二十面体结构,T值为3,直径约27nm,内部为病毒核酸。病毒含4种结构蛋白,分别为VP1、VP2、VP3和VP4,其中VP1、VP2和VP3构成了病毒衣壳的外层结构,VP4在衣壳内部。
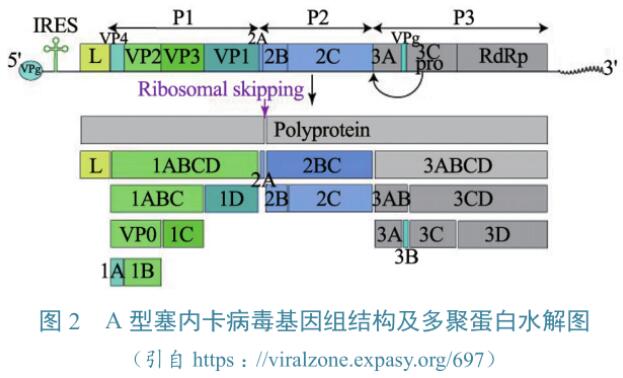
SVA基因组
SVA基因组(图2)为单股、线性、正义RNA,长度约为7300nt。基因组5'末端结合VPg,为非帽子结构,靠近5'末端为IV型内部核糖体进入位点(internal ribosome entry site,IRES),为蛋白翻译的上游非编码区域,约666nt。基因组3'末端为poly(A)结构,长度约为70nt。SVA基因组仅含有一个较长的开放阅读框(open reading frame,ORF),编码一个约2180aa的多肽,而后经过进一步加工,形成不同的结构蛋白和非结构蛋白。
各蛋白在基因组中呈“L-4-3-4”样排列(图2),即“Leader-4个P1区多肽-3个P2区多肽-4个P3区多肽”。P1区对应结构蛋白VP0、VP3和VP1,VP0又进一步加工形成VP2和VP4。P2和P3区对应非结构蛋白,主要参与蛋白加工和病毒复制。所有非结构蛋白中,2A蛋白的形成机制较为特殊,其总长为9aa,羧基末端为保守基序NPG/P,因此可通过核糖体跳跃机制使蛋白翻译“中止”但不“终止”。
临床症状
自然感染
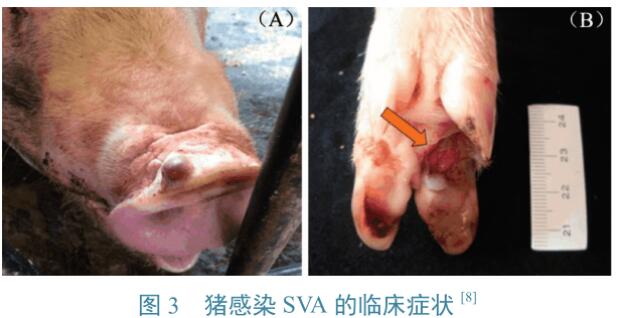
高毒力SVA自然感染猪后会导致典型的水疱型临床症状,与猪的某些其他疫病症状类似,如口蹄疫、猪水泡病及水泡性口炎等。动物感染SVA后,在鼻吻处会出现水疱性病变,通常为大小不一、充满液体的水疱(图3-A),破裂后可形成溃疡面(图3-B),多日后形成结痂。水疱性及溃疡性病变多出现于蹄冠带和趾间隙,导致边缘上皮疏松坏死,严重者站立及行走困难。患病动物同时伴有厌食、精神沉郁、体温升高等现象。某些患病仔猪3~10d后,症状可消退并临床康复。
人工感染
国外学者通过动物实验深入研究了SVA的致病机制。通过口鼻途径进行SVA感染动物实验,4d后便可观察到典型的临床症状。病毒血症持续期较短,通常维持在感染后的3~10d。感染后1~28d,便可在口鼻及粪便中检测病毒。若为急性感染,1~5d后口腔中的病毒分泌量便可达到峰值。2019年Buckley等对15只8月龄母猪进行了SVA鼻内感染试验,发现感染2d后,4只母猪的蹄冠带便出现水疱样病变,其他母猪在感染5d内在该部位皆出现类似病变;6只母猪感染4d后,口吻部出现水疱样病变。病毒血症持续1周,感染后7d,出现血清中和抗体。大部分水疱样病变感染2周后便自行消退。
国内分离株(GD-S5/2018和GD04/2017)的小鼠感染实验结果显示,通过肌肉、皮下及口服途径感染,GD-S5/2018株可导致较高的致死率,但GD04/2017株却未导致明显的临床症状。猪感染实验结果显示,GD-S5/2018株可导致典型的临床症状,如齿龈和舌部出现溃疡性病变,但GD04/2017株攻毒后,猪仅表现沉郁,未有SVA感染的典型临床症状。这说明GD-S5/2018是强毒株,而GD04/2017的毒性较弱。2020年Zhang等比较了另外2个国内分离株(HB-CH-2016和CH/AH-02/2017)的毒力,发现CH/AH-02/2017株可导致明显的临床症状,而HB-CH-2016株的致病性相对较弱。
流行病学
国际SVA感染情况
SVA是一种新发病原体。2007年加拿大首次报道了SVA感染病例。2012年美国报道了猪群中有SVA流行,但追溯发现2010年已有猪群发病。2014年前,除北美地区外,SVA未在其他地区报道,直到2014年末,巴西报道了首例SVA感染病例,而与美国和加拿大不同的是,巴西的SVA感染不仅局限于成年猪,新生仔猪亦有感染。随后其他国家皆发现了SVA感染的病例,包括中国(2015)、哥伦比亚(2016)、泰国(2016)和越南(2018)等。
2015—2016年是全球局部地区的SVA感染高发期。对此期间的SVA分离株基因组序列进行遗传进化分析,发现各毒株间的基因同源性较高(95.8%~99.9%),而与历史株SVV-001的同源性较低(93.8%~94.6%)。基于SVA VP1基因部分序列(541bp)进行遗传进化分析,可将病毒分为3个以时间为参考的基因系(Clade),分别为Clade I、Clade II和Clade III。Clade I为SVA原型毒株,如88-23626株(Genbank:EU271759);Clade II为历史毒株,如SVV-001株(Genbank:DQ641257);Clade III为当前毒株,如CH-LX-01-2016(Genbank:KX751945)。Clade III基因系毒株最多,包括美国、加拿大、巴西、中国和泰国的分离株。
国内SVA感染情况
2015年,SVA首次传入我国广东省2个猪场,导致猪群出现水疱型病变及新生仔猪死亡。在排除口蹄疫、猪水疱性口炎等疑似疫病后,最终确诊为SVA感染。2016年,湖北省某猪场出现SVA感染病例,其分离毒株(HB-CH-2016株)与广东省首个分离毒株(CH-01-2015)核酸同源性极高,说明两次疫情具有密切的流行病学相关性。2016年12月,黑龙江省某猪场的育肥猪经检测感染SVA,其分离株与美国毒株同源性高于其他中国毒株,说明此次黑龙江分离株可能源自美国。2017年,河南省和福建省几乎同时报道了SVA感染,分离自这两个省份的3个毒株间具有极高的核酸同源性,说明三者可能源自同一毒株。
近些年,SVA在我国某些省份再次出现,尤其广东省时常有SVA感染的报道,且分离株已呈现出不同的进化分支。张志等将2016—2018年15个省份的数百份临床病料进行检测,发现大部分省份皆检测到阳性。结合已有报道,目前SVA感染的省、自治区和直辖市包括广东、广西、云南、贵州、湖南、福建、四川、湖北、河南、山东、新疆、上海、辽宁和黑龙江等14个,表明SVA已在我国不同地域广泛流行。2019年代蕾等报道了海南省同样存在SVA感染,应用间接 ELISA 方法,对海南省2547份猪血清样品进行SVA抗体检测,结果抗体阳性率为10.9%。
SVA自2015年传入我国后,已进化出5个遗传分支。遗传进化分析表明,大部分分离株与美国毒株的同源性较高。SVA在我国正以较快的速度进化,同时不断有报道称,毒株间已发生重组并形成新的重组病毒。病毒间的重组,使SVA在我国的遗传多样性更加复杂,因而也增加了潜在的跨物种传播风险。
诊断方法
病原学诊断
因SVA为RNA病毒,所以目前建立的病原学检测方法为基于RNA的检测。针对的检测区域主要为基因组的3D、5'端UTR或VP1内部的保守片段,建立的方法为常规RT-PCR、定量RT-PCR、数字RT-PCR及RT-LAMP等,另有SVA和FMDV双重RT-PCR检测方法的报道。病原学检测,尤其定量RT-PCR,其敏感性可达10拷贝/μL,且与口蹄疫、水泡性口炎等类似疫病无交叉反应,因此是常见的临床核酸检测方法。数字PCR技术是一种核酸分子绝对定量技术,已应用至SVA感染的病原学检测。相较于荧光定量PCR,数字PCR能够直接对核酸分子拷贝数进行绝对定量。然而,病原学检测的缺点显而易见,即病毒在不同组织的载量(或排毒量)随时间变化的差异性会导致检测结果出现差异。因此,为保证检测结果的准确性,应尽量采集不同组织的样品用于检测,如血清、淋巴结、粪便、唾液及水疱液等。
血清学诊断
SVA血清学诊断主要是基于血清抗体的检测,目前已建立的方法包括间接ELISA、竞争ELISA及病毒中和试验等。竞争ELISA是目前应用最为广泛的血清学检测方法,也有商品化检测试剂盒在售。该方法的敏感性和特异性较为理想,推荐临床检测使用。病毒中和试验的敏感性和特异性皆高于竞争ELISA,但操作过程复杂,且需数日才可判定结果,因此不适用于SVA感染的快速诊断。
疫苗研发
SVA在猪群中流行已有十余年,但仍无商品化疫苗,猪场只能采用生物安全措施对其进行防控,因此开发高效疫苗至关重要。
活疫苗
SVA在体内能诱导体液及细胞免疫反应。2019年Sharma等通过反向遗传技术拯救了一株重组SVA,并在猪体内评估了重组病毒的免疫原性及免疫保护性。结果显示,重组病毒是一株弱毒株,动物经接种后未出现明显临床症状,病毒血症及排毒现象都相对较弱。虽然毒力致弱,但重组病毒依然维持着较理想的免疫原性。4周龄仔猪经单次肌内注射及滴鼻免疫后,可在免疫后3~7d内产生较高滴度的中和抗体。除了诱导体液免疫反应,重组活病毒还可诱导记忆性T细胞(CD4+、CD8+及CD4+/CD8+ T细胞)的增殖反应。而且,仔猪经免疫后可以耐受异源SVA的人工感染,攻毒后并未表现出明显临床症状,且病毒血症、排毒量及组织病毒载量都有所降低,说明该重组SVA是一株有效的活疫苗候选株。
灭活苗
虽然活疫苗可以诱导理想的体液及细胞免疫反应,但具有潜在的生物安全风险,如毒力反强。而灭活苗不具有潜在的生物安全风险,因此是另一种理想的候选疫苗。2018年Yang等通过二乙烯亚胺将SVA灭活后,与油佐剂混合乳化制备了灭活疫苗。动物免疫试验显示,该灭活苗可诱导理想的中和抗体反应,且攻毒后动物未表现出明显临床症状,说明该油佐剂灭活苗是有效的SVA候选疫苗。
结语
SVA是近些年在多个国家出现的一种跨境传播病毒,可导致典型的水疱型临床症状,已对多国养猪业造成了不同程度的影响。SVA感染目前在国内未像非洲猪瘟那样给养猪业带来毁灭性的影响,但不应忽视的是SVA属于RNA病毒,可能具有较强的变异性,因此该病毒未来的流行态势如何演变,目前很难预测。而且,目前仍无商品化疫苗可用,且国内诊断试剂研发相对滞后,这都不利于该病毒的防控。因此,相关工作者应当密切关注SVA在全球的流行现状,并深入研究SVA的致病及免疫机理,同时研发有效的疫苗和诊断试剂。
|
