|
A型猪塞内卡病毒CH-HNXC株灭活疫苗免疫效果评价
赵文影,燕?贺,王玉宙,姚亚丽,徐 鑫,田克恭 *,张云静 *,逄文强 *
(国家兽用药品工程技术研究中心,河南 洛阳 471000)
塞内卡病毒病(Senecavirus Disease,SVD)是由A型塞内卡病毒引起的一种水疱病。SVA属于小RNA病毒科、塞内卡病毒属中唯一成员,其基因组为单股正链不分节段的RNA病毒。SVA感染后各个年龄段猪群均可发病。临床上主要表现为猪鼻吻、蹄部水疱病变,母猪伴有发热和厌食,新生仔猪伴有腹泻、脱水等症状。
自2015年国内首次发生SVA疫情,之后其他省份均有报道,给我国养猪业带来很大的损失和威胁。SVA感染后引起的病变与口蹄疫、猪水疱病、水疱性口炎等相似,很难区分,严重困扰我国口蹄疫的防控。SVA的广泛传播和存在导致了新的变异株出现。据报道,中国存在不同类型的SVA毒株。此外,SVA基因组变异和重组可能导致病毒免疫原性和毒力的改变。目前,还没有行之有效的策略来限制SVA的传播。近年来,实验室开发了一些可以检测SVA感染的方法,如iELISA、cELISA、病毒中和抗体测定、RT-PCR等方法。然而,国内市场上尚无商品化SVA疫苗。
灭活疫苗因其制备工艺简单、成本低、安全性高,能够快速诱导机体产生体液免疫而广泛应用。SVA CH-HNXC株是国内流行毒株。基于此,本试验利用BHK-21细胞繁殖SVA CH-HNXC株病毒液,使用BEI灭活后配合201佐剂制备灭活疫苗,免疫30~35 d仔猪,免疫28 d后使用SVA CH-HNXC毒株攻毒,评价疫苗的免疫原性和保护效果。
1
材料与方法
INTRODUCE
1.1 毒种、细胞来源
A型猪塞内卡病毒CH-HNXC毒株由国家兽用药品工程技术研究中心分离并保存。乳仓鼠肾细胞(BHK-21)购自中国典型培养物保藏中心,并由国家兽用药品工程技术研究中心传代保存。
1.2 试验动物
10头30~35日龄非洲猪瘟、口蹄疫、SVA抗原抗体阴性猪购自非疫区。
1.3 主要试剂
201佐剂购自Seppic公司,DMEM培养基购自Gibco公司,二乙烯亚胺(BEI)购自Sigma公司。SVA单克隆抗体2G10和酶标单抗6D2均为国家兽用药品工程技术研究中心制备。
1.4 SVA灭活、检验及疫苗的制备
将繁殖的P9代SVA病毒液加入终浓度为2 mmol/L的二乙烯亚胺(BEI)溶液,37℃灭活36 h,灭活期间每隔6 h摇匀病毒液一次,而后加入终浓度为2 mmol/L硫代硫酸钠,37℃反应2 h,灭活后抗原取1 mL病毒液。
取1 mL灭活后的病毒液,用无血清DMEM做10倍稀释,接种至长至单层的BHK-21细胞的T25细胞瓶,置37℃、5%的CO2培养箱中培养48 h,冻融1次,取1 mL上清液, 按照上述方法盲传3代,观察并记录细胞病变。如无细胞病变,则病毒灭活完全。
1.5 动物免疫及攻毒
将10头30~35日龄非洲猪瘟、口蹄疫、SVA抗原抗体阴性猪只,随机分成2组,每组5头。第一组为免疫组,颈部肌肉注射2 mL SVA灭活疫苗,第二组为攻毒组,颈部肌肉注射2 mL DMEM培养基。免疫28 d后第一组和第二组颈部肌肉注射CH-HNXC株P8代病毒液,2 mL/头,108.0TCID50/mL。
1.6 临床及病理
攻毒后观察并记录猪只体温、口鼻和蹄部是否出现水疱或溃烂等临床症状,持续14 d。对攻毒试验中死亡或试验结束剖检的仔猪,取病变处组织进行HE染色和免疫组化(IHC)检测。
1.7 SVA中和抗体检测
分别在免疫0 d、7 d、14 d、21 d和28 d采集猪只血液并分离血清,使用固定病毒-稀释血清法进行如下操作:取200TCID50/50 μL的病毒液与2倍系列稀释的灭活后待检血清等量混合,设正常细胞对照孔、血清对照孔和病毒对照孔,置37℃作用1 h。每孔加入BHK-21细胞悬液(8%血清的DMEM培养液重悬细胞)50 μL(含2.5×104.0个细胞)。将细胞培养板置37℃、5%的CO2培养箱中培养,逐日观察至第3天判定结果。正常细胞对照孔和血清对照孔应无CPE,病毒对照孔应出现CPE,否则结果不成立,以能抑制50%以上细胞出现CPE的血清最高稀释度的倒数判定为该血清SVA中和抗体效价。
1.8 ELISA抗体检测
分别在免疫0 d、7 d、14 d、21 d、28 d采集猪只血液并分离血清,按照如下方法进行ELISA抗体检测,取SVA单克隆抗体2G10以终浓度为10 μg/mL进行包被,50 μL/孔,轻轻振荡混匀,4℃过夜;弃去液体,洗涤3~5遍,最后一次尽量扣干,每孔加入150 μL封闭液,轻轻振荡混匀,用封板膜封板后37℃温育2 h;弃去液体,洗涤3~5遍,最后一次尽量扣干,每孔加入10倍稀释的SVA灭活抗原,50 μL/孔,用封板膜封板后37℃温育1 h;弃去液体,洗涤3~5遍,最后一次尽量扣干,分别加入50 μL阴性对照和阳性对照(各2孔),以及50 μL 10倍稀释的待检血清,轻轻振荡混匀,用封板膜封板后37℃温育1 h;弃去液体,洗涤3~5遍,最后一次尽量扣干,每孔加入50 μL酶标抗体HRP-6D2(1:10 000),轻轻振荡混匀,用封板膜封板后37℃温育30 min;弃去液体,洗涤3~5遍,最后一次尽量扣干,每孔分别加入50 μL显色A液和显色B液,37℃避光温育10 min;每孔加入50 μL终止液,用酶标仪在450 nm波长下读取OD值。结果判定:阻断率PI=1-(血清OD/阴性对照平均OD)×100%,阻断率≥40%时为阳性,阻断率<40%时为阴性。
2
结果与分析
INTRODUCE
2.1 免疫后SVA抗体水平
免疫0 d、7 d、14 d、21 d和28 d采集猪只血样分离血清。利用血清中和试验检测SVA中和抗体水平,结果显示,攻毒组猪只血清中和抗体一直为阴性;免疫组猪只在免疫7 d后中和抗体水平开始升高,免疫14 d后,猪只SVA中和抗体效价平均达到1:256,免疫28 d后,达到高峰(见图1)。利用ELISA方法检测SVA特异性抗体水平,结果显示,攻毒组猪只血清SVA特异性抗体阻断率均<40%;免疫14 d后,免疫组猪只SVA特异性抗体阻断率均>40%,全部转阳;免疫28 d后,猪只特异性抗体水平达到高峰(见图2)。
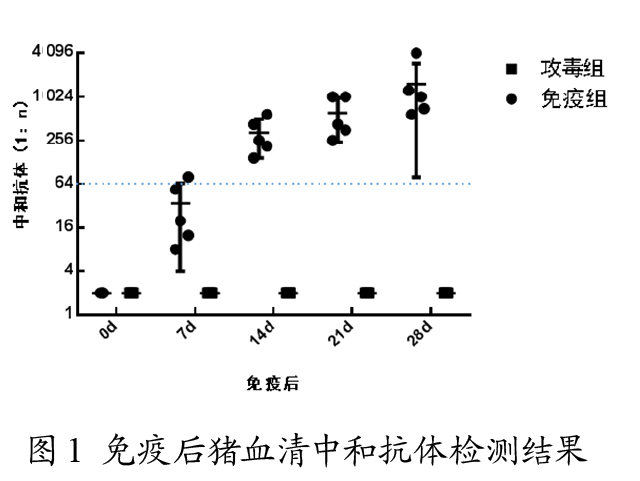
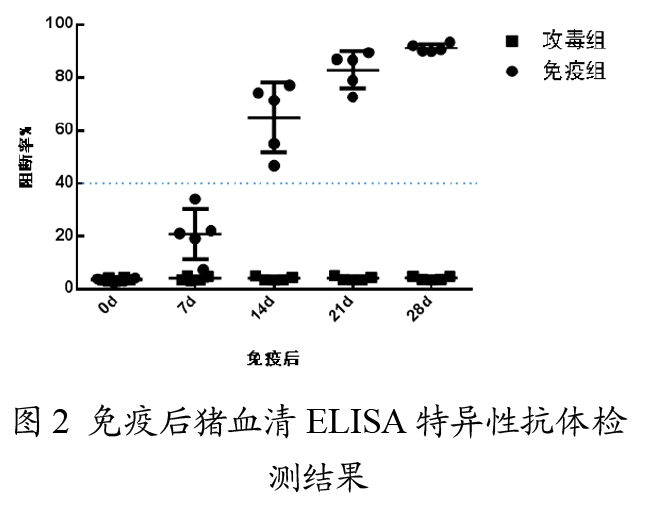
2.2 攻毒后体温变化
免疫组猪只在攻毒1~14 d内体温正常,无明显升高。攻毒组在攻毒2 d后有2头猪开始体温开始升高;攻毒3 d后,5头猪体温均高于40℃;攻毒5 d时,猪只体温最高烧至41℃,之后体温下降,在攻毒后8 d基本恢复正常(见图3)。
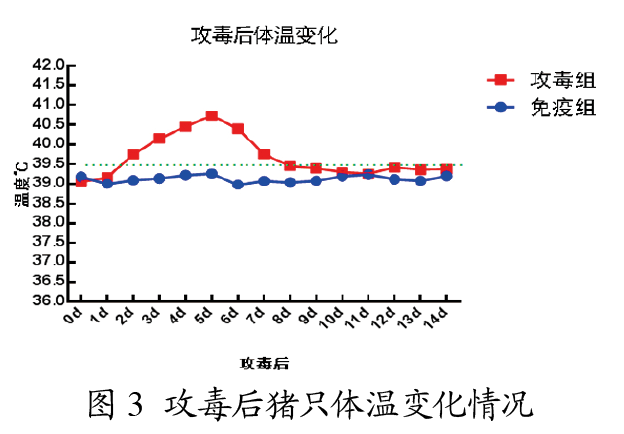
2.3 攻毒后临床症状
免疫组在接种疫苗后无不良反应,接种部位无炎性反应。攻毒后,免疫组猪只未出现明显的临床症状;攻毒组在攻毒后4 d,4头猪的蹄冠处或趾间隙有水疱产生,第5 天时,5头猪的蹄冠处或趾间隙均有明显的临床症状(见图4);攻毒后6 d,个别猪水疱开始溃烂结痂,攻毒14 d,攻毒组猪只蹄冠处或趾尖隙基本恢复正常。
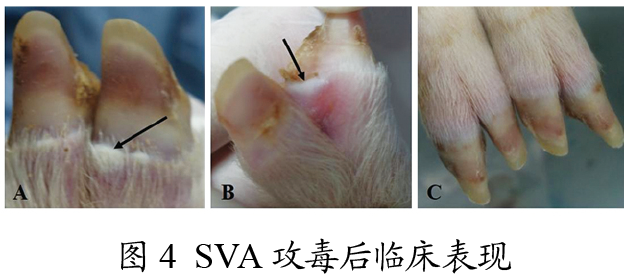
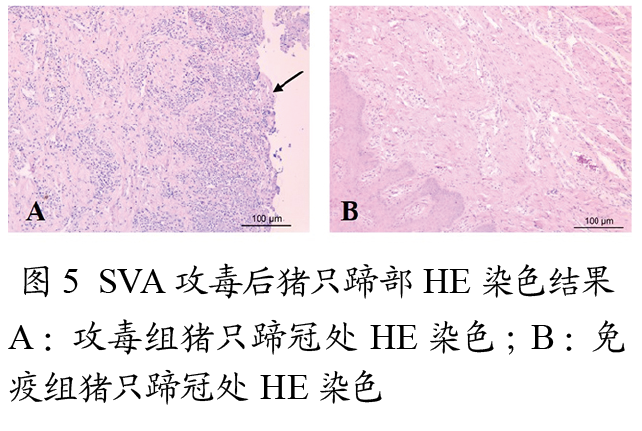
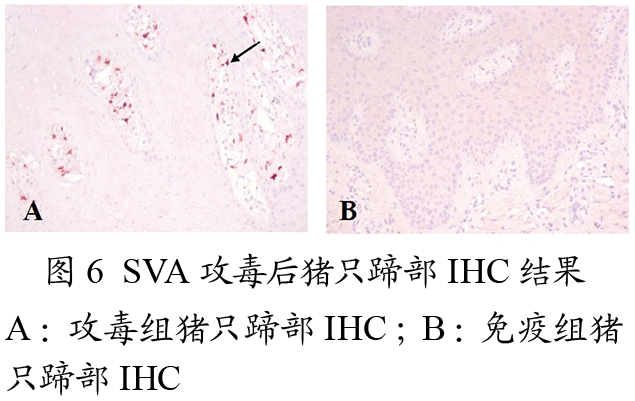
2.4 HE染色和IHC结果
SVA攻毒14 d后剖检猪只可见HE染色(见图5),攻毒组猪只猪蹄冠处皮肤的表皮层大面积坏死、缺损,直接裸露真皮层,真皮层出血、坏死,大量淋巴细胞浸润;免疫组猪只蹄冠处皮肤HE染色结果正常。IHC结果显示:攻毒组猪只的蹄部检测到SVA抗原阳性,免疫组猪只SVA抗原阴性(见图6)。
3
讨论
INTRODUCE
疫苗接种是控制传染病的主要手段。SVA感染后影响猪群生产,且不易与其他水疱病区分,容易造成误诊,引起恐慌,给养猪业造成严重的经济损失。SVA长期循环、传播和变异使得该病的防控更加复杂化。因此,研发一种安全有效的疫苗对于SVA防控具有重要的意义。
近年来随着研究的深入,人们对SVA致病性有了更多的认识,Yang等利用SVA -CH-FJ-2017株制备灭活疫苗,通过对猪只的免疫保护效果评价,证明了该灭活疫苗对猪具有良好的免疫原性,可诱导机体产生高水平中和抗体病抵御病毒感染。Bucldey等利用全病毒灭活疫苗免疫育肥猪和母猪后同样产生高滴度的中和抗体水平,且能够抵御病毒感染。
体液免疫应答水平是评价灭活疫苗保护效果的首要趾标,而体液免疫应答水平往往通过测定中和抗体和特异性抗体对疫苗诱导机体产生的免疫应答能力进行评估。本实验室通过血清中和试验对疫苗免疫后抗体水平进行评估;基于前期建立的SVA感染模型,本试验使用SVA CH-HNXC株灭活后,配合201佐剂制备灭活疫苗,并对其免疫保护效果进行评价,结果显示,与未免疫组相比,一次免疫后能产生高水平抗体,且在攻毒后未表现出临床症状,这与Yang等研究结果一致。
病毒中和试验是检测动物血清抗体的金标准,但是操作繁琐、耗时长,对实验的要求较高,不利于SVA快速诊断。本试验在采用自建SVA阻断法ELISA对免疫后血清中抗体进行检测,免疫14 d后抗体转阳;与中和抗体检测结果相比,ELISA抗体检测方法更加便捷、快速。
4
结论
INTRODUCE
本试验采用BEI灭活剂灭活SVA CH-HNXC株病毒液后,配合201佐剂制备灭活疫苗,免疫30~35日龄仔猪,免疫28 d后均产生高滴度的中和抗体和特异性ELISA抗体;使用SVA CH-HNXC毒株仔猪进行攻毒,免疫攻毒组猪只未出现发热、水疱等明显的临床症状,攻毒组猪只5/5发病,说明制备的SVA灭活疫苗具有良好的免疫原性和保护效果。综上所述,SVA CH-HNXC株灭活疫苗可作为候选疫苗进行深入研究,有助于预防和控制SVA感染。
|
